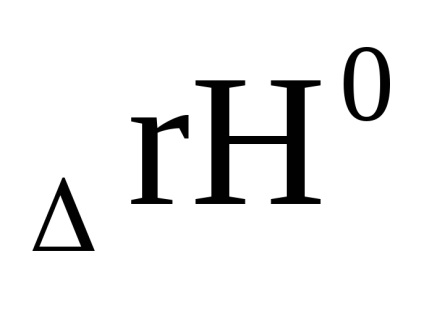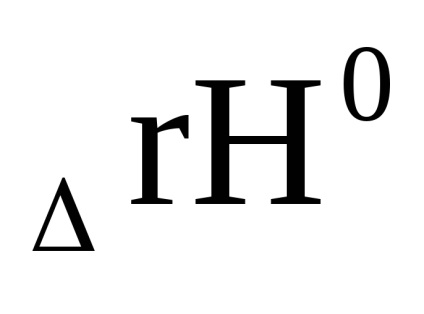Egyenletben kémiai reakció izotermák
0 + RT lnpi a

(Parciális nyomások nem egyensúlyi állapotban)
A összeg az első konzol, amint az a levezetése (1,84), azzal a megkötéssel Δ G = 0 egyenlő -R lnKp. Következésképpen, Δr G = -R lnKp + RT (+ SR dr'D - ar'A - br'V) vagy
Δr G = RT (ln
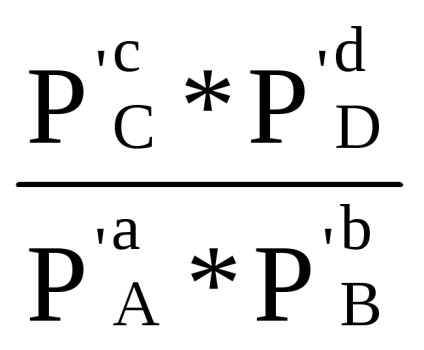
A kapott egyenletet nevezzük izoterma kémiai reakció (vagy a van't Hoff-egyenletből 1886 YG), összeköti a Gibbs energia a reakció a kémiai egyensúlyi állandó és a kezdeti parciális nyomása a reagensek.
Ha a parciális nyomása minden területen a kezdeti reakcióelegyben egysége (PI = 1), majd a egyenlet (1,87) következik, hogy
0 Δr G = -R ln Cr (1,88)
A mennyiség Δr G 0 - szabványos izobár-izoterm reakció potenciál a kiválasztott hőmérsékleten - T. cseréje után -RTlnKr naΔr G 0, egyenletet (1,87) válik:
Δr G = Δr G 0 + RT ln
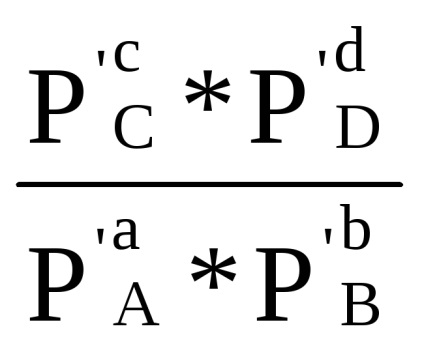
Ez látható a következő egyenletből, hogy a változás a izobár-izoterm potenciális reakciót két részből áll. Az egyik része Δr G 0 - változás a hipotetikus reakció, amelyben a reaktánsokat venni standard állapotban. Egy adott G 0 reaktsiiΔr - állandó p, T, amely attól függ, csak a a reaktánsok természetétől. A második kifejezés egyenletben (1,89) tükrözi zavisimostΔr G 0 az összetétele a reakció-lánc.
Ez egy növekedés isobariás-izoterm potenciál, amelyet úgy kapunk, halad a reagensek, kombinálhatók bármely parciális nyomásainak (koncentrációk) a reakciótermékek, valamint kombinálhatók bármely parciális nyomás.
A függőség az egyensúlyi állandó hőmérséklet. Egyenletben izobár reakciót.
Kémiai egyensúly dinamikus, mozog az egyik vagy másik irányba a feltételek megváltoznak. Különösen a egyensúlyi helyzetben, és így az egyensúlyi állandó hőmérsékleti hatások.
A funkcionális függését egyensúlyi állandó a hőmérséklet állandó nyomás lehet beszerezni a reakció izoterma egyenletet (1,87) és a Gibbs egyenlet - Helmholtz (1,70).
Differenciálás egyenlet izoterma reakcióhőmérséklet (1,87), figyelembe véve, hogy a p'A. p'B. R. r'D meg, és a hőmérséklet nem változik, megkapjuk
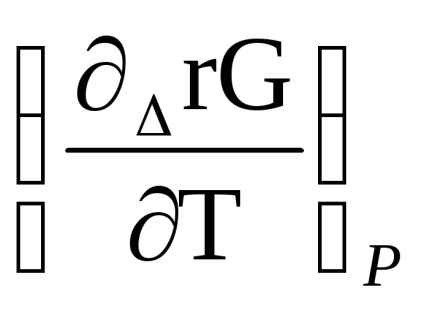
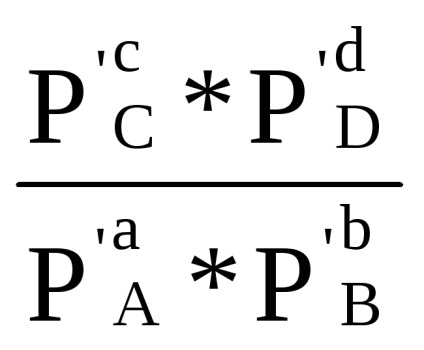
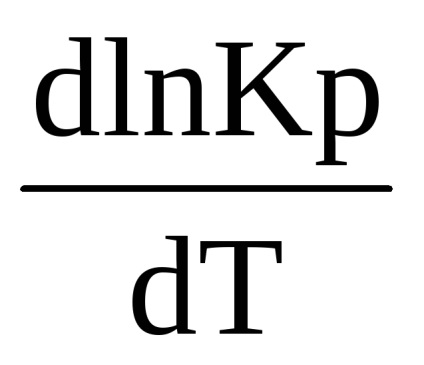
Helyettesítsük a Gibbs - Helmholtz:
Δr G (t) = Δr n (t) + T [
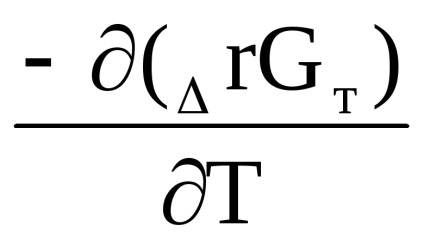
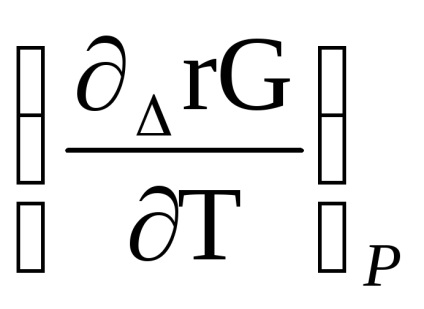
RTln
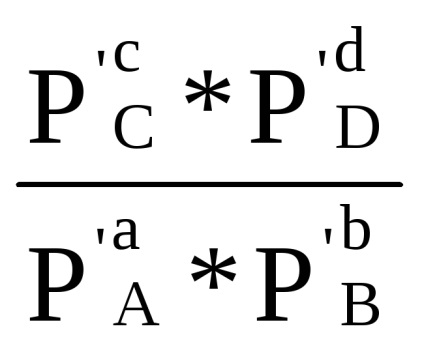
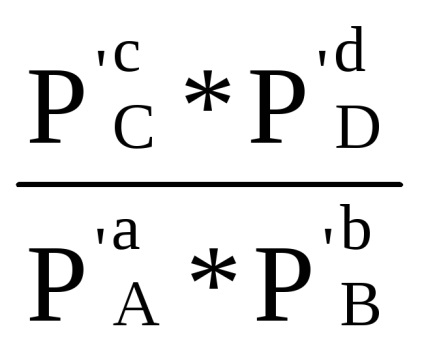
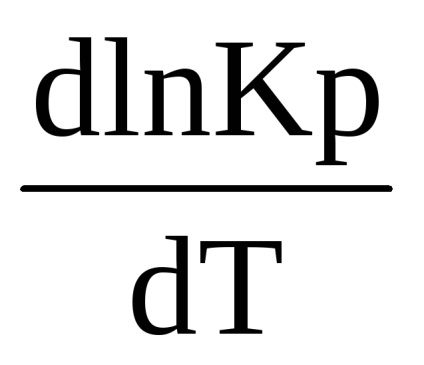
Csökkentés után kapjuk:
Ez az egyenlet megállapítja közötti kapcsolatot az egyensúlyi állandó, és a hőmérséklet-változás a reakcióhőt. Ez vonatkozik folyamatok zajlanak állandó nyomáson, és az úgynevezett egyenlet a izobár (van't Hoff 1885 YG)
Egyenlete egyensúlyi számítások különböző hőmérsékleteken (1,90) integrálni kell. Elválasztása után a változók van
A szűk hőmérséklet-tartományban a hő a reakció lényegében független a hőmérséklet, azaz a Δ Cp = 0. Ezért, miután az integráció beszerzése
ahol B - az integrálási állandót.
Összehasonlítása alapján egyenlet (1,91) egyenlet (1.88a) azt mutatja, hogy a B =
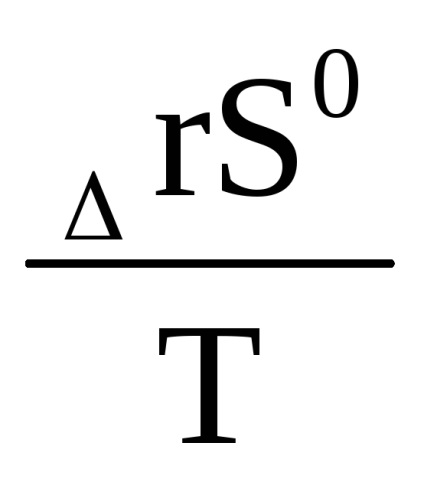
Egyenlet (1,91) kapcsolatos standard körülmények felírható:
ahol
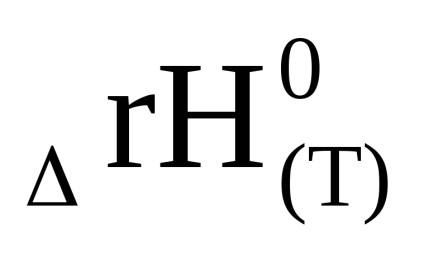
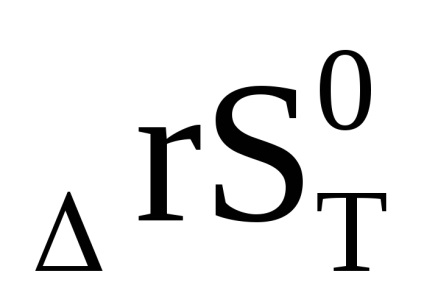
Egyenletből (1,92), hogy az LN Cr, és így az egyensúlyi állandó a hőmérséklet emelkedésével nőhet vagy csökkenhet. Ez együtt jár a jel a entalpiaváltozást
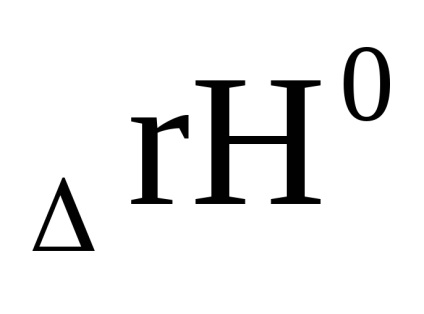
Ha az előre reakció exoterm (