kémiai egyensúly
A legtöbb kémiai reakció reverzibilis: Amellett, hogy egy közvetlen reakció (reakció kiindulási anyagok) és a reverz történik (reakció reakció termékei között). Mivel minden egyes reakciók folyamatosan ellátja reagenseket a reakció az ellenkező irányba, egyikük nem áll meg, és az egész rendszer dinamikus jellegű. Egy bizonyos ponton az időben előre és hátra a reakció sebessége egy vonalban - kémiai egyensúly a rendszerben. Kémiai egyensúlyok egy dinamikus egyensúly, mivel ez a két ellentétes folyamat történhet azonos sebességgel.
Az az anyagok koncentrációjának egyensúlyi állapotban az úgynevezett egyensúlyi kormányzati koncentrációban vannak összekötve - változó egyikük jár azonnali változás mások.
Kísérleti vizsgálatok azt mutatják, hogy a reverzibilis reakció az általános formája
egyensúly az alábbi összefüggés az azonos és a tavaszi anyagok koncentrációja:
Ez a kapcsolat egy matematikai kifejezés a kémiai egyensúly a törvény (a tömeghatás törvénye). Ez azt mutatja, hogy a termék egyensúlyi koncentrációinak (fokokban indexek egyenlő a megfelelő sztöchiometrikus arányokat) a kiindulási anyagok és a reakció termékek vannak kötve egymással keresztül állandó érték K. nevezett kémiai egyensúlyi állandó.
Kémiai rendszer, amely elérte az egyensúlyi állapotot, ott lesz mindaddig, amíg nem változik a feltételeket, amelyek mellett ez az egyensúly létrejön. egyensúlyi állapot változás eredményeként a külső körülmények változását az úgynevezett elmozdulás a kémiai egyensúly. Ha a közvetlen reakció kezdi uralni eredményeként a külső körülmények változását, akkor azt mondjuk, hogy az egyensúly jobbra tolódik. Ezzel szemben, a domináns gyorsulás a fordított reakció tekinthető az eltolódás az egyensúlyt a bal oldalon.
A gyakorlatban a kémiai egyensúlyi eltolódás leggyakrabban alkotnak ispol'uet-változást a hőmérséklet, nyomás és koncentráció.
egyensúlyi eltolódás várható iránnyal Chatelier elv. ha a rendszer egyensúlyban, van külső befolyás (változás hőmérséklet, nyomás, koncentráció anyagok), az egyensúly eltolódik az áramlás a reakció, amely gyengíti ezt a hatást.
Más szóval, ha egyensúlytalanság rendszer igyekszik visszatérni az egyensúlyi állapot (ami a legjövedelmezőbb energia), hogy a szállítási rendszer bármilyen értelemben, hogy gyorsítja a reakciót, amelynek során a legtöbb ellenzi a külső beavatkozást.
Kísérleti eljárás és TELJESÍTMÉNY
Eszközök, berendezések, reagensek
Termosztát vízfürdőben, hőmérővel, stopper, csövek főzőpohár pipettával 5 ml és 10 ml. 2% -os kénsavat H2 SO4. 2% -os oldat natriyaNa2 tioszulfát S2 O3. 2% keményítő oldat, telített nátrium-klorid-zhelezaFeCl3, tiocianát KSNS kálium-klorid, KC1 kálium mediCuSO4-szulfát. Lugol (droppers) oldatot.
1. kísérlet A függőség a kémiai reakció sebessége a reaktánsok koncentrációja
A függőség a kémiai reakció sebessége a reagensek koncentrációja tanulmány a reakció a nátrium-tioszulfáttal, a kénsav:
A kapott tiokénsavval, instabil és könnyen bomlik:
A teljes folyamat leírható a következő:
A folyosón a reakció lehet megítélni változás az oldat tisztaságát. A reakció eredményeként a szabad kén, ami a zavarosságát.
Annak vizsgálatára, a befolyása a koncentrációja az egyik reagenst a reakció sebességét kell tartani többször változtatjuk, az oldat koncentrációja a kiindulási reaktáns, de állandó értéken tartva a koncentrációt a második reagenssel.
Koncentrációjának változtatásával a nátrium-tioszulfát, mérjük azt az időt a kisülési megoldások előtt zavarosságot. Ekkorra intervallum (τ) fogja megítélni a relatív aránya a kémiai reakciót.
A öt kémcsőbe pipettázunk (10 ml) tárcsázza 10 ml 2% -os kénsavval.
Öt másik cső pipetták (5 ml) oldatához típusú 2% -os nátrium-tioszulfát és a víz a táblázatban látható mennyiségben 4 (nem tévesztendő pipettával!)
Egyesítése páronkénti elkészített oldat nátrium-tioszulfát és a kénsav egy főzőpohárban, stopper, mérni az időt a kisülési megoldások előtt zavarosságot. Rekordot 4. táblázatban megoldás a csapadékot pour, üveg, mosás, öblítés desztillált vízzel, és töltse meg a következő kísérletben.
Számítsuk ki a relatív sebességek öt végzett reakciók során az alábbi képlet szerint:
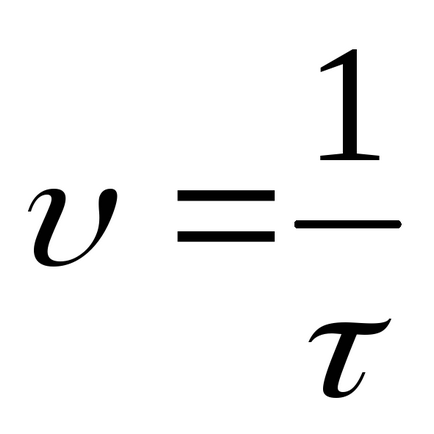
Rögzítse az eredményeket a kísérletek 1. táblázatban.
Számítsuk ki a relatív koncentrációja Na2 S2 O3 képlet
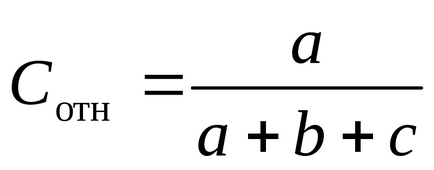
Rögzítse az eredményeket a kísérletek 1. táblázatban.
Ábrázoljuk a relatív reakció sebessége függ a relatív koncentrációja Na2 S2 O3.
Hogy a következtetést a hatását a koncentráció a reakció sebességét. Megjegyzés a függőség a reakciósebesség a koncentrációja (átmenő egyenes a származási, parabola). Mi az, hogy a reakció vizsgálták ebben a reagens? Általános következtetések, hogy hogyan változik a reakció mértéke növekvő koncentrációjú reagens.
1. táblázat - végzett kísérletek eredményei, hogy meghatározzuk a kémiai reakció sebessége, attól függően, hogy a koncentráció a kezdeti reaktánsok
2. kísérlet Kémiai függése a reakció sebessége a hőmérséklet a reagensek
A függőség a kémiai reakció sebessége a hőmérséklet a reagensek Ugyanebben a vizsgálatban a reakciók:
Ebben az esetben, a koncentráció a kénsav és nátrium-tioszulfát változatlan marad, de megváltoztathatja a hőmérséklet, amelynél a kísérletet végeztünk.
A két cső pipettáztunk 5 ml naleytepo 15 ml 2% -os oldat natriyaNa2 tioszulfát S2 O3.
Pipettázzunk 10 ml naleytepo másik két kémcsőbe 10 ml 2% -os kénsavat H2 SO4.
Tartalmazó két csőben, oldatok H2 SO4 iNa2 S2 O3 nagreytena vízfürdőben, amelyben a víz hőmérséklete eltér szobahőmérséklet és 10 ° C (plusz 2-3 ° C-on egy fűtési üvegcsövek és a diszperzió).
A fűtött megoldások leeresztő főzőpohárba zapishitevremya származó, amikor elvezetését folyadékok, amíg zavarosodás.
Ismételjük egyszer több tapasztalat az azonos mennyiségű reagensek, a következő két kémcsőbe, de a hőmérséklet 20 ° C-on (plusz 2-3 ° C) magasabb, mint az eredeti. Írja le az időt, amíg az oldat zavarossá válik. Idő előfordulási zavarosság szobahőmérsékleten, vett 4. táblázat (5. kísérlet).
Számítsuk ki a relatív reakció sebessége és a hőmérsékleti együtthatója a reakció sebességét. Record eredmények a 2. táblázatban.
Az adatok alapján következtetéseket levonni a hőmérséklet hatását a reakció sebességét. Hogyan változtatni a kémiai reakció sebessége magasabb hőmérsékleten minden 10 ° C?
2. táblázat - végzett kísérletek eredményei, hogy meghatározzuk a függését az arány a kémiai reakció a hőmérséklettől
3. kísérlet A függőség a kémiai reakció sebessége a katalizátor jelenlétében
Amikor a kölcsönhatás a kálium-tiocianát és vas-klorid (III) tiocianát képződött vörös vas:
Ha hozzáadjuk a vas-tiocianát nátrium-tioszulfát történik eltűnése a vörös szín miatt a reakció:
A katalizátor ennél a reakciónál a Cu 2+ ionok.
Ahhoz, hogy 20 ml víz egy kis főzőpohárban, adjunk hozzá 1-2 csepp telített oldatok FeCI3 és KSNS. (Ha az oldatot kapott nagyon intenzív színező, t. E. Nem átlátszó, meg kell hígítani vízzel, hogy halvány piros szín).
Az így kapott oldatot öntsük 2 fiola 7,5 ml.
A másik két cső öntsünk 5 ml nátrium-tioszulfát; az egyikben, 2 csepp réz-szulfát-oldatot.
Az első kémcsőbe oldattal vas tiocianát gyorsan öntsük nátrium-tioszulfát-oldattal, beleértve egyidejűleg a stoppert. Megjegyzés: az időt, ami után a piros szín eltűnik.
Ahhoz, hogy a második cső oldattal vas tiocianát gyorsan öntsük nátrium-tioszulfát-oldattal, hogy a réz-szulfát egyidejűleg, beleértve egy stopperórát. Megjegyzés: az időt, ami után a piros szín eltűnik.
Készítsen kiszámítása relatív sebessége a reakció képletű
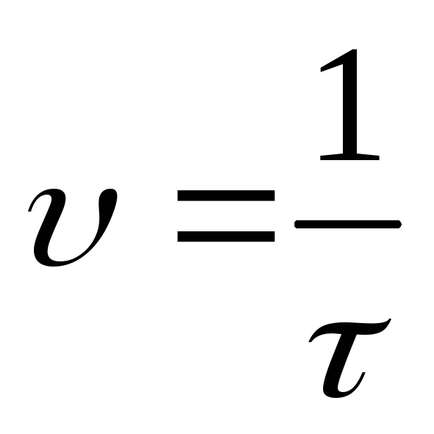
Record eredményeket a 3. táblázatban.
Hogy a következtetést a hatás Cu 2+ ionok a reakció sebességét.
3. táblázat - végzett kísérletek eredményei, hogy meghatározzuk a függőség a mértéke egy kémiai reakció által a katalizátor jelenlétében
4. kísérlet A hőmérséklet hatása a kémiai eltolódás az egyensúlyi
Koncentrációjának hatása a kémiai eltolódása az egyensúlyi reakció, amely vizsgálni kialakulását tiocianát vas (III) egy színváltozást a reakcióelegy koncentrációja esetén a reagensek egyike:
A tiocianát vas Fe (CNS) 3 intenzív színű sötét vörös színű, FeCl3 - sárga, KSNSi KC1 - színtelen, és amikor a változó kontsentratsiiFe (CNS) 3 az oldat színe változik, ami azt jelzi, az eltolási irányára egyensúlyt.
Ahhoz, hogy 20 ml víz egy kis főzőpohárban, adjunk hozzá 1-2 csepp telített oldatok FeCI3 és KSNS. (Ha az oldatot kapott nagyon intenzív színező, t. E. Nem átlátszó, meg kell hígítani vízzel, hogy halvány piros szín).
Az így kapott oldatot öntsük 4 csövekbe.
Az első kémcsőbe adjunk hozzá néhány csepp FeCl3 oldat, másodsorban - KSNS oldatból néhány cseppet a harmadik - negyedik KC1 szabadságot ad az összehasonlításra. Monitoring és rögzítse az eredményeket a 4. táblázatban.
Magyarázza meg a megfigyelt jelenségek segítségével Chatelier elv. Írja kifejezés egy egyensúlyi állandó. Általános következtetések a bekövetkező változások hatását koncentrációjának kezdeti és végső anyagok az egyensúlyi helyzet.
4. táblázat - végzett kísérletek eredményei, hogy meghatározzuk a hőmérséklet hatását a kémiai eltolódás az egyensúlyi
Tapasztalat 5. Hatás a koncentráció a kémiai eltolódás az egyensúlyi
Hőmérséklet hatása a helyzet a kémiai egyensúly a reakciót vizsgáltuk jóddal kölcsönhatás a keményítő összekeverését egy kék színű komplexet anyagösszetétel, amely szokásosan az úgynevezett „yodokrahmalom”:
A két cső öntsünk 5 ml keményítő-oldatot, és adjunk hozzá cseppenként jód amíg a kék szín.
Az egyik cső elhagyja az összehasonlítás, egy másik hő. Megjegyzés: a színváltozás.
Hűtőszekrényben cső víz (folyó víz alatt). Hasonlítsa össze a szín a két csövet.
4. Magyarázd megfigyelt jelenségek segítségével Chatelier elv. Határozza meg a irányát egyensúlyi eltolódás, attól függően, hogy a növekedés vagy csökkenés a hőmérséklet. Általános következtetések a hőmérséklet hatása az egyensúlyi helyzet.
Ellenőrző kérdések és feladatok
Mit jelent az a kémiai reakció sebességét? Adj a koncepció az átlagos és a valódi reakció sebességét.
Ahonnan a fő tényező nagyságától függ a reakció sebessége?
Mivel a reakció sebességét függ a hőmérséklettől?
Mivel a reakció sebessége függ a reaktánsok koncentrációja? Mi a kinetikus egyenlet?
Hogyan kísérletileg meghatározzuk a sorrendben a reakciót a reagens?
Mit jelent egy reverzibilis kémiai reakció?
Mi a dinamikus jellege a kémiai egyensúly?
Egy kifejezés az állandó kémiai egyensúly.
Mivel lehet megjósolni a elmozdulás iránya, amikor a változó a kémiai egyensúly a reakciókörülmények (hőmérséklet, nyomás, koncentráció)?