Fázis egyensúly
Napjainkban a fizika nagyon közismert tudománysá vált. A szó szerinti értelemben mindenhol jelen van. A legelemibb példa: az udvarban egy almafa nő, és gyümölcsöt énekelnek, eljön az idő és az almák elkezdenek leesni, de milyen irányba esnek? Az univerzális gravitáció törvényének köszönhetően gyümölcsünk a földre esik, vagyis leesik, de nem felfelé. A fizika egyik leghíresebb példája volt, de figyeljünk a termodinamikára, pontosabban a fázisbeli egyensúlyra, ami nem kevésbé fontos az életünkben.
termodinamika

Először nézzük meg ezt a kifejezést. θερμοδυναμική - ez a szó görögül. Az θερμο első része a "hő" kifejezésre utal, a második pedig δυναμική a "hatalom". A termodinamika a fizika egyik ága, amely egy makroszkopikus rendszer tulajdonságait tanulmányozza, valamint az energia átalakításának és továbbításának különböző módjait. Ebben a részben különféle állapotokat és folyamatokat különítünk el annak érdekében, hogy bemutassuk a hőmérséklet fogalmát a leírásba (ez egy fizikai mennyiség, amely termodinamikai rendszert jellemez és bizonyos eszközök segítségével mérhető). A termodinamikai rendszerekben előforduló összes folyamatot csak mikroszkópos mennyiségek (nyomás és hőmérséklet, valamint komponensek koncentrációja) írják le.
A Clapeyron-Clausius egyenlet
Minden fizikus ismeri ezt az egyenletet, de elemezzük részenként. Ez egy bizonyos anyag átmeneti folyamatának egyensúlyi folyamatait jelenti az egyik fázisból a másikba. Ez tökéletesen látható ilyen példákon: olvadás, párolgás, szublimáció (a termékek megőrzésének egyik módja, amely a nedvesség teljes eltávolításán megy keresztül). A képlet egyértelműen bemutatja a folyamatokat:
- n = PV / RT;
- ahol T az anyag hőmérséklete;
- P a nyomás;
- R a fázisátmenet specifikus hője;
- V az adott térfogat változása.
Az egyenlet története

A Clapeyron-Clausius egyenlet kiváló matematikai magyarázata a termodinamika második törvényének. A továbbiakban "Clausius egyenlőtlenség". Természetesen a tudós maga dolgozott ki a tételt, aki meg akarta magyarázni a rendszer hõáramának és az entrópiának, valamint a környezetnek a kapcsolatát. Ez az egyenlet Clausius azon kísérleteiben fejlődött ki, hogy megmagyarázza az entrópiát és meghatározza azt. A szó szerinti értelemben a tétel lehetővé teszi annak meghatározását, hogy a ciklikus folyamat visszafordítható vagy visszafordíthatatlan-e. Ez az egyenlőtlenség mennyiségi képletet kínál a második törvény megértéséhez.
Zárt elszigetelt rendszer
Az elszigetelt rendszer az alábbi módok egyike:
- A fizikai rendszer messze van a többiektől, amelyek nem érintkeznek velük.
- A termodinamikai rendszert merev, rögzített falak zárják, amelyeken keresztül sem anyag, sem energia sem képes átadni.
Annak ellenére, hogy a téma belső súlyára utal, egy elszigetelt rendszert általában a külső gravitációs és más távoli erők határain kívül hoznak.
Ez szembeállítható a tény, hogy (a általánosabb használt terminológia termodinamika) egy zárt rendszer, szelektív hím falak, amelyen keresztül átvihető energia hő vagy munka, de nem számít. Olyan nyílt rendszerrel, amelybe az anyag és az energia bejut vagy kilép, bár határokon belül is különböző átjárhatatlan falak lehetnek.
Az elszigetelt rendszer megfelel a természetvédelmi törvénynek. Leggyakrabban a termodinamikában, az anyagban és az energiában külön koncepcióként kezelik.
Termodinamikus átmenetek
A kvantumfázis-átmenetek megértéséhez hasznos a klasszikus transzformációkhoz (más néven termikus megforduláshoz) hasonlítani. A CPT leírja a visszatérési pontot a rendszer termodinamikai tulajdonságaiban. Jelzi a részecskék átszervezését. Tipikus példa a víz fagyasztási átmenete, amely egy folyadék és egy szilárd anyag közötti sima transzformációt ír le. A klasszikus fáziskialakulások a rendszer energiájának és a termális ingadozások entrópiájának közötti versenyen alapulnak.
A klasszikus rendszer nulla entrópiával rendelkezik, és ennek következtében a fázisátalakulás nem fordulhat elő. Rendelésüket az első diszkontinuált derivált termodinamikai potenciál határozza meg. Természetesen elsőrendű. A ferromágnesről a paramágnetre vonatkozó fázishatranszformációk folyamatosak és másodrendűek. Ezeket az állandó változásokat a rendezettől a rendezetlen fázisig egy nullás rendelési paraméter írja le. A fent említett ferromágneses transzformáció esetében a rend paraméter a teljes mágnesezés lesz.
A Gibbs Potenciál
A szabad Gibbs energia az expanzió nélküli munkák maximális száma, amelyek eltávolíthatók egy termodinamikus zárt rendszertől (amely hőcserét és munkát végezhet a környezetben). Az ilyen maximális eredmény csak teljesen reverzíbilis eljárással érhető el. Amikor a rendszert inverz módon transzformáljuk az első állapotról a második állapotra, a szabad Gibbs energia csökkenése megegyezik a környezetében végrehajtott rendszerrel, a nyomóerők munkája nélkül.
Egyensúlyi állapotok

A termodinamikai és mechanikai egyensúly a termodinamika axiomatikus koncepciója. Ez egy vagy több rendszer belső állapota, amelyek többé-kevésbé áteresztő vagy áteresztő falakkal vannak összekötve. Ebben az állapotban nincsenek tiszta makroszkopikus áramlások az anyagtól vagy az energiától, sem a rendszeren belül, sem a rendszerek között.
A belső egyensúly állapotának saját koncepciójában makroszkopikus változás nem következik be. A rendszerek egyszerre helyezkednek el a kölcsönös termikus, mechanikai, kémiai (állandók), sugárzási egyensúlyban. Egyforma formában lehetnek. Ebben a folyamatban minden faj azonnal tárolódik, és végtelen mennyiségű időt vesz igénybe, amíg a fizikai működés meg nem szűnik. A makroszkopikus egyensúlyban teljesen helytálló kiegyensúlyozott cserék zajlanak. A fenti bizonyíték fizikai magyarázata ennek a koncepciónak.
Minden törvény, tétel, képlet alapja. Elemezzük a fázisegyenlet törvényének 3 alapját.
- A fázis egy anyagforma, amely homogén a kémiai összetételben, a fizikai állapotban és a mechanikai egyensúlyban. A tipikus fázisok szilárdak, folyékonyak és gázneműek. Két, egymással nem elegyedő folyadékot (vagy különféle összetételű folyékony keverékeket) tartalmazó, külön határral elválasztott folyadékot két különböző fázisnak és nem elegyedő szilárd részecskének tekintünk.
- A (C) komponensek száma a rendszer kémiailag független komponenseinek száma. A rendszer összes fázisának összetételéhez szükséges független fajok minimális száma.
- A szabadságfokok (F) száma ebben az összefüggésben azoknak az intenzív változóknak a száma, amelyek nem függenek egymástól.
Fázisegyenletesség szerinti osztályozás
- A folyamatos tiszta átvitel (gyakran a szilárd fázisú reakciók) reakciói különböző összetételű szilárd anyagok között fordulnak elő. Ide tartoznak a folyadékokban (H, C) található elemek, de ezek az összetevők szilárd fázisban maradnak fenn, így a folyékony fázisokat (H2O, CO2) nem használják reagensként vagy termékként. A tiszta átvitel szilárd reakciói lehetnek folyamatos vagy szakaszosak, valamint végsőek is.
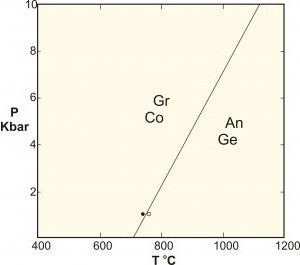
- A polimorfok egy speciális típusú szilárd fázisú reakció, amely azonos összetételű fázisokat tartalmaz. Klasszikus példák az alumínium-szilikátok, a kyanite-sillimanite-andalusite közötti reakciók, a grafit nagy nyomáson és a kalcium-karbonát egyensúlyára való átalakítása.
Az egyensúly törvényei

Gyári Gibbs kellett döntenie Josiah Willard Gibbs, a híres cikk címe: „Equilibrium heterogén anyagok”, amely megjelent az évek 1875-1878. Ez vonatkozik a nem-reaktív többkomponensű heterogén rendszerek termodinamikai egyensúlyban van az alábbi egyenlet adja:
- F = C-P + 2;
- ahol F a szabadságfokok száma;
- C az összetevők száma;
- P a termodinamikai egyensúlyi fázisok száma egymással.
A szabadságfokok száma az elfogyasztott intenzív változók száma. A legtöbb termodinamikai paraméter, például hőmérséklet vagy nyomás, amelyek egyidejűleg és önkényesen változhatnak, anélkül, hogy befolyásolnák egymást. Egy egykomponensű rendszer egy olyan rendszer, amely egy tiszta vegyi anyagot tartalmaz, és a kétkomponensű rendszerek, mint például a víz és az etanol keverékei, két független komponenssel rendelkeznek. Tipikus fázisátalakulások (fázisegyensúly) szilárd anyagok, folyadékok és gázok.
A fázisszabály állandó nyomáson
A különböző szilárd struktúrák közötti fázisváltozásokhoz kapcsolódó anyagtudományi alkalmazások esetében gyakran állandó nyomás (például egy légkörben), és a szabadság mértékét figyelmen kívül hagyja, így a szabály: F = C - P + 1.
Néha meg ezt a képletet az úgynevezett „szabály a kondenzált fázisban”, de, mint tudjuk, ez nem vonatkozik ezekre a rendszerekre, amelyek ki vannak téve a magas nyomás (pl geológia), mert a hatása ezeknek a nyomás következtében az katasztrofális következményekkel járhat.
Úgy tűnhet, hogy a fázis egyensúlyi - csak üres frázis, és nem kevés fizikai folyamatok ebben az időben, de mint láttuk, nem őt, sok törvényt nem ismeri a számunkra, ezért van szükség egy kicsit ismeri ezeket a különleges, színes, bár chut enyhén unalmas szabályok. Ez a tudás sok embert segített. Megtanultak maguknak alkalmazni, például a villanyszerelők, a fázisokkal való munkavégzés szabályainak ismeretében, megvédhetik magukat a felesleges veszélyektől.
