Az egyenlet a Van der Waals erők fizika
Az egyenlet a van der Waals-linkek a fő termodinamikai paramétereinek igazi gáz.
Alacsony nyomáson és magas hőmérsékleten Mengyelejev-Clapeyron törvény is elég pontosan leírja a viselkedését valós gázok, hanem más gázok aktuális feltételek jelentősen eltérnek az ideális. Az egyenlet a van der Waals-erők lehetővé teszi ezeket az eltéréseket.
A képlet a van der Waals
Az egyenlet a van der Waals a formája:
Ebben az egyenletben n - a mólszáma a gáz, p - a nyomás. V - a hangerőt a gáz által elfoglalt, T - abszolút hőmérséklete a gáz. Az egyetemes gázállandó értéke 8,31441 J / (mol • K), az egyenlő az összes gáz.
Részben valamint - ez egy módosítás, hogy az erő a vonzás közötti gázmolekulák. Hatása alatt ez az erő a molekulák vonzzák egymást belsejében a gáz, csökkentve a nyomást a falon. Változó b - miatti korrekció saját térfogatának a gázmolekulák. Ezek a módosítások függ a gáz típusától, és megtalálható a táblázatokban vagy kiszámítható az alábbi képlettel:
Itt és - a nyomás és az abszolút hőmérséklet a gáz a kritikus pont, azaz az átmeneti ponton a gázfázis a folyadékba.
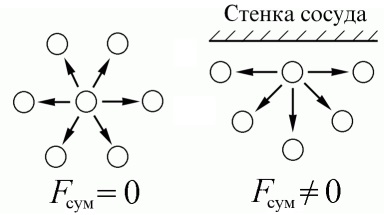
A valós távolságot a gázmolekulák kevesebb, mint ideális, és hasonló a méret a molekulák magukat. Ezért, a kölcsönhatás erő közötti molekulák ekkor elég nagy. A kötet a gáz molekula körül minden oldalról más molekulák, és azok vonzóerők kiegyensúlyozottak. Azonban, ha a molekula közel van a falon, a vonzóerő nem kiegyensúlyozott és „szívja” bele. Ezért, a molekula mozog a fal lassan, ami miatt a fal nyomás csökken. Ez a módosítás figyelembe veszi a kútba.
Továbbá, mivel a intermolekuláris erők reális gázok képesek átadni a folyékony állapotban, és az egyenlet a van der Waals elég pontosan leírja a gázok viselkedését közelében ez az átmenet.
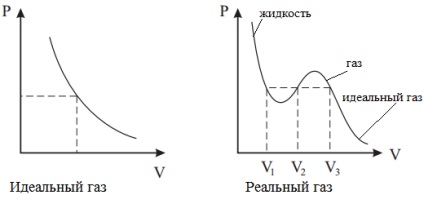
Mivel egy igazi gáz közötti távolság molekulák viszonylag kicsi, a molekula repülni egy rövidebb távolságot érintette a falat. Ezért nagyon nagy nyomáson növeli a nyomást a falon, és ez lehetővé teszi a korrekció b.
Az egyenlet a van der Waals erő hat, különösen, amikor meghatározzák a két paraméter a hő és hőtechnikai a tanulmány a gáz cseppfolyósító.
Példák problémák megoldása
Mi hőmérsékletet nitrogén súlyú 2 gramm, amely elfoglalja a térfogata 800 cm nyomáson 0,2 MPa, ha értelmezhető valós gáz?
Szorzása egyenlete van der Waals-erők és az elosztjuk p, megkapjuk az egyenlet egy térfogatra:
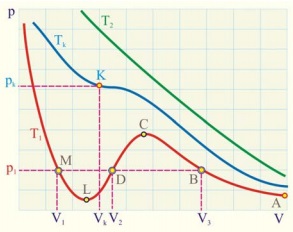
Ez az egyenlet három gyökereit. Az inflexiós pont az ábrán látható, az összes a gyökerek valós és egyenlő. Az inflexiós pont az a kritikus pont, ahol a gázfázis a folyadékba.
Ahhoz, hogy megtalálja a kritikus paramétereket használja a tulajdonságait az inflexiós pont: az első és a második derivált az egyenlet eltűnik.
Mi megoldjuk ezeket az egyenleteket a hangerő és a hőmérséklet, megkapjuk a kritikus paraméterek:
Kifejezése nyomás az egyenlet van der Waals és az írás az egyenletet a kritikus paraméterek, kapjuk:
Helyettesítse Ebben az egyenletben, és miután az oldat már kapott:
Írunk az egyenletrendszert:
Engedje meg, hogy belőle b:
Behelyettesítve b a második egyenletbe, megkapjuk: