Móltömeg ólom (Pb), és példák a általános képletű
Ólom - kémiai elem elhelyezve a hatodik időszakban a periódusos rendszer IVB csoportjába tartozó DI Mengyelejev.
Sorszám - 82. A szerkezet egy atom ábrán látható. 1. Fém d-család.
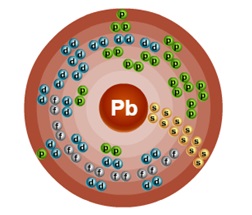
Ábra. 1. ábra a vezető atom.
Normális körülmények között, az ólom olyan anyag szilárd állapotban van kékes-fehér. Ami a vezetést felület ragyog. A levegő és a filmmel bevont oxidok e elhalványul. Nagyon puha és késsel. Ez kis hővezető. Sűrűség 11,34 g / cm 3 Olvadáspont 327,46 o C Forráspont 1749 ° C-on
Moláris ólom súlya 207,2 g / mol. Ez az érték azt jelzi, a tömeg aránya az anyag (m) -edik móljainak száma egy adott anyag (n), M-mel jelölt, és lehet képlettel számítottuk ki:
Más szóval, a moláris tömege az anyag - a súlya 1 mol az anyag, g / mol vagy kkmol.
Ólom létezhet mint gáz csak abban a formában szilárd anyagok, így annak érdekében, hogy megtalálják a értékei a molekulatömeg nem tudja használni az érték a moláris mennyiség, vagy a számítások az alábbi képlet segítségével Mengyelejev-Clapeyron.
Példák problémák megoldása
Tedd egyenlet hidrolízis reakciók ólom-nitrát (II). Mi lesz a reakció közegében a megoldást erre a só?
Az egyenlet a disszociációs ólom-nitrát (II):
Ezt a sót kialakítva egy gyenge bázis (-hidroxid, ólom (II) Pb (OH) 2) és erős sav (salétromsav HNO3), így a hidrolízis előrehaladásával a kation.
Pb 2+ + HOH ↔ PbOH + + H +;
PbOH + + HOH ↔ Pb (OH) 2 ↓ + H +;
a reakcióközeg savas, amint azt a hidrogén jelenlétében ionok.
Előállítása ólom-nitrát (II) tömeg 80g (tömeghányad só, 6,6%) emelkedett nátrium-jodid-oldattal 60 g (NaI tömegtörtje 5%). Tömegének kiszámításához ólom-jodid (II), kicsapódik.
Az egyenlet reagáló ólom-nitrát (II) nátrium-jodidot:
Azt találjuk, oldott anyag tömege ólom-nitrát (II) és nátrium-jodidot:
ω = msolute / msolution × 100%;
msolute = ω / 100% × msolution;
msolute (NaI) = ω (NaI) / 100% × msolution (Nal);
msolute (NaI) = 5/100 = 60% × 3 g
Azt találjuk, móljainak a száma az anyagok nem reagált (moláris tömege ólom-nitrát (II) 331 g / mol, nátrium-jodid - 150 g / mol), és meghatározza, hogy ezek közül melyik feleslegben van:
n (NaI) = msolute (NaI) / M (Nal);
n (NaI) = 3/150 = 0,02 mól.
Nátrium-jodidot feleslegben van jelen, így az összes ezt követő számítások lefolytatásával ólom-nitrát (II). N (Pb (NO 3) 2). n (PbI2) = 1: 1, azaz a N (Pb (NO 3) 2) = n (PbI2) = 0,016 mol. Ezután a tömege ólom-jodid (II) egyenlő lesz (móltömeg - 461 g / mol):
m (PbI2) = 0,016 × 461 = 7,376 g