Móltömeg a salétromsav (HNO3), az összes képlet
Móltömeg a salétromsav
Salétromsav normál körülmények színtelen folyadék (sűrűsége 1,52 g / cm 3), forráspontja 82,6 ° C, és olyan hőmérsékleten, (-41,6 ° C) megszilárdítjuk egy átlátszó kristályos masszát.
A szerkezet a salétromsav molekula ábrán látható. 1. Meg lehet keverni vízzel bármilyen arányban. Van egy erős elektrolit, azaz szinte teljesen disszociál ionokra vizes oldatban. Az ISI viselkedik, mint egy oxidálószer.
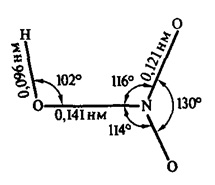
Ábra. 1. Szerkezet salétromsav molekula meghatározva vegyértékkötés szögek és hosszúságú kémiai kötéseket.
Molekuláris képlet salétromsav - HNO3. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Mr (HNO3) = Ar (H) + Ar (N) + 3 × Ar (O);
Mr (HNO3) = 1 + 3 + 14 × 16 = 1 + 14+ 48 = 63.
Móltömeg (M) - a súlya 1 mol hatóanyagra vonatkoztatva. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy a moláris tömege salétromsav 63 g / mol.
Példák problémák megoldása
Tedd képletű magnézium vegyületet, kén- és oxigénatom, ha a tömeg aránya a elemek benne m (Mg): m (S): m (O) = 3: 4: 8.
Annak érdekében, hogy megtudja, milyen módon a kémiai elemek a molekulában kell találni száma anyagot. Köztudott, hogy a képletet kell használni a megállapítás mennyiségek:
Azt találjuk, a moláris tömege magnézium, kén és oxigén (értékek relatív atomtömege vett Mendeleev Periódusos Táblázat egész számra kerekítve). Ismeretes, hogy M = úr, eszközt (Mg) = 24 g / mol, M (S) = 32 g / mol, és M (O) = 16 g / mol.
Ezután az anyag mennyiségét Ezen elemek:
n (Mg) = m (Mg) / M (Mg);
n (Mg) = 3/24 = 0,125 mol.
N (S) = 4/32 = 0,125 mol.
N (O) = 8/16 = 0,5 mól.
Találunk mólaránya:
n (Mg): n (S): n (G) = 0,125: 0,125: 0,5 = 1: 1: 4.
azaz Formula magnézium vegyületet, a kén és oxigén formájában van MgSO4. Ez a magnézium-szulfát.
Tedd képletű kénvegyület az oxigénnel, amikor a tömegarányai elemek benne: ω (S) = 40%, ω (O) = 60%.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (kén), és az „y” (oxigén). Ezután a mólarány a következő lesz (az értékek a relatív atomi tömegeket vett Mendeleev Periódusos Táblázat egész számra kerekítve):
x: y = ω (S) / Ar (S). ω (O) / Ar (O);
x: y = 1,25. 3,75 = 1. 3.
Formula így kén- és oxigén-vegyületek formájában fog SO3. Ez a kén-oxid (VI).