Bevonat a sav-rezisztens mikroorganizmusok
Festési Ziehl-Nielsen.
1. A rögzített kenet bevont lángját szűrőpapírcsíkra, ez öntjük Carboline fuchsin oldatot és melegítjük; amikor egy gőz melegítést leállítjuk, és hagyjuk, hogy festeni készítmény néhány percig (2-3 perc). Miután a gyógyszer lehűlni, a papír eltávolítjuk csipesszel és vízzel mossuk kenet.
2. A fehérítő készítmény 5-10% -os vizes kénsav Techa beállított 3-5 másodperc (az sárgás színárnyalatot kenet). Kénsav helyett lehet alkalmazni egy 5% -os salétromsav vagy 3% -os sósav-oldattal.
A kenet alaposan mossuk vízzel.
5. Ismét vízzel mossuk.
6. Dokrashivayut 3-5 percig Leffler metilénkék vizes oldat vagy 1: 1000 malachitzöld vagy egy metil-zöld.
7. A festék kompozícióba és a mosóvíz Võsu Shiva.
Kenetek: TB bacillus - rubinvörös, és a többi, kivéve a paratuberculosis kórokozója, a sav - és az alkohol szaprofitákkal - kék. A fehérítő kenet festést Ziehl-Neelsen helyett savak és az alkohol, különösen ajánlott a sósav alkoholt (3 ml sósavat + 96 ml 97 ° alkohol) enyhén rózsaszínes színárnyalatot érzékelhető gyógyszer. Ezután kenetet dokrashivayut vízzel öblítjük és metilénkéket, és így tovább. G. főbb recept. A fenti eljárást úgy érhető el egyidejűleg tesztelés saválló bacillusok - és az alkohol. Típusok között saválló szaprofitákkal talált spirtopodatlivye fajok bacillus tuberkulózis és paratuberkulózist mindig a sav - és alkohol.
4. szekció Bevonat kapszula és spóraképző baktériumok. Meghatározása mikrobiális motilitás.
A cél a képzés. Learn módszerek spóra színű, kapszula-képző baktériumok, valamint a meghatározását a bakteriális motilitás.
Anyagok és berendezések. Az ugyanezen baktérium vakcina törzs lépfene, Clostridium, felhasználásra kész készítmények kapszula baktériumok tenyészlevet Escherichia mozgatható 18 órás növekedés, csúszdák és fedőlemezzel, plakátok, 2% szafranin oldattal, vizes malachitzöld Ziehl-féle oldat.
Módszertani útmutató. Minden diák készít kenetet a szuszpenziók a mikroorganizmusok és a színük módszerével Trujillo, Olten mikroskopiruyut és vázlatok; gyógyszer előállítására a tanulmány a mobilitását mikroorganizmusok által „zúzott” és „lógó” csepp.
Színezés a vitát. Kedvezőtlen körülmények között mikrobiális (hiánya tápközeg, szárítás, és más kedvezőtlen hőmérséklet.) A citoplazmában bizonyos mikrobiális spóra képződnek. Ezek képezünk a vegetatív sejteket, endospórák. Rod-alakú Gram-pozitív mikroorganizmusok képző spórák kerek, amelynek átmérője nem haladja meg a szélessége a mikrobiális sejtek tartoznak roduBacillusi nevezett bacilusok. Mikroorganizmusok rodaClostridiumimeyut spórákat átmérője meghaladja a szélessége a mikrobiális sejtek, és az úgynevezett Clostridiumok. A formában vannak ovális és kerek (ábra. 5).
Spórák ellenállnak a magas hőmérsékletnek, a vegyi anyagok, kiszáradás, sokáig marad a talajban, mert a sajátos szerkezete és kémiai összetétele, különösen a héj. Ezért viták hatásának ellenálló festékek.
Minden módszer a színezés a vita alapja az, hogy a festék behatolását a bőrön keresztül achromophilous viták. Ezért a maró használni. Lehűlés után ismét shell tömörödéséíg és nem továbbít további festék.
festéstechnika vitát Trujillo. A rögzített kenet szabhat egy kis darab szűrőpapírra, és alkalmazzák vizes malachitzöld.
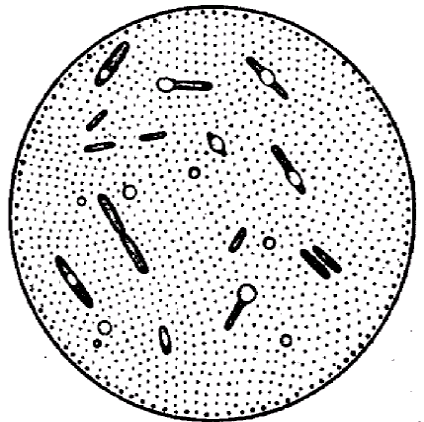
Kábítószer-ra előmelegített az égő lángja, amíg a füst, és 3 percig, vízzel mossuk és dokrashivayut 0,25% -os vizes bázikus fukszin 1 percig. Vízzel mossuk és szárítjuk. A mikro-: zöld spórák és vegetatív sejtek piros.
Bevonat a kapszulák. mikrobiális sejt testet borítja laza réteg nyálkahártya. Egyes mikroorganizmus-fajok, ez a réteg a fejlődő nagyon erősen, és aztán felhívott egy kapszula. Kapszula - mucin-szerű anyag, nagy molekulatömegű poliszacharid származik külső héj réteget. A jelenléte a kapszula fontos diagnosztikai jelző azonosításakor kórokozók és differenciálódása bizonyos fertőzések (anthrax, pneumococcus pneumónia, stb) (ábra. 6.). Patogén mikroorganizmusok képezik a kapszulának a fertőzött szervezet. Ez egy virulencia faktor és védi a bakteriális sejtek fagocitózis és baktericid hatása szérum. Tok anyag rosszul festett. Ezért, amikor kapszula előállítására, kimutatására a következő szabályok:
a) előállítunk egy kenetet a friss anyagot, mint a kapszula gyorsan lizált;
b) kémiailag fixált kenetet, metohromoticheskie használt tinta festés, azaz a használat során, a citoplazmájába, amelyek színezett egy szín, és a kapszula - más;
c) víz mossa a kenet legyen gyenge és rövid.
Technika színező kapszulák Olta módszerrel. Friss, forró 2% szafranin oldatot felvisszük a rögzített kenet megfestett 5-7 percig. Gyorsan vízzel mossuk és szárítjuk. A sejt test, piros színű tégla színű kapszula - sárga-narancs. Meghatározása bakteriális mozgékonyságát.
Bakteriális mozgékonyságát fontos jele a faj és a végzett diagnosztikai vizsgálatok: az eredmény figyelembe azonosítása mikroorganizmusok. A mobil fajok képesek önfenntartó (és rotációs) mozgalmak jelenléte miatt ostoros - speciális vékony fonalas szerkezetek.
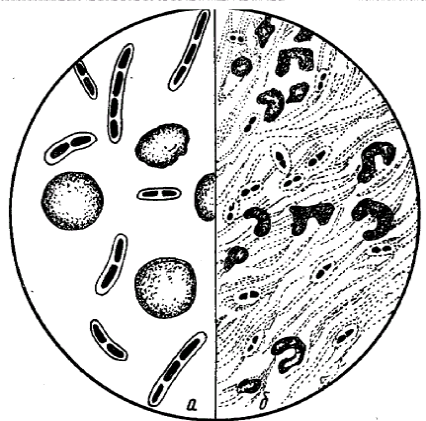
Ris.6.Kapsula baktériumokban és - Bacillus anthracis; b - diplococcus
Flagellumok különböző hosszúságú.
Átmérője olyan kicsi, hogy nem látható a fénymikroszkóp (alább 0,2 mikron). Különböző csoportok baktériumok számát és helyét ostoros másképp. Csilló rossz érzékelik a színeket. Módszerek komplex színező torzítják hiteles formában csilló, így laboratóriumokban színezés csilló nem történik meg, és a vizsgált baktériumok élő állapotban. Attól függően, hogy a helyét és mennyiségét a mikrobák megoszlanak csillók (7. ábra):
a) monotrihi - mikroorganizmusok, amelyek az egyik elemnél egy flagellum mozgás aktív, progresszív (Pseudomonas);
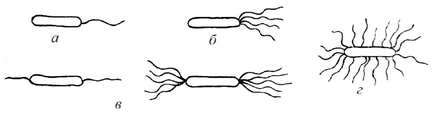
Ábra. 7. típusú bakteriális Ostoros formák
b) lofotrihi - mikrobák, amelynek az egyik pólus gerenda csillók (Listeria);
c) amfitrihi - rendelkező baktériumok flagellumok mindkét pólus a mikrobiális sejtek;
g) peritrich - mikrobák amelynek flagellumok vannak elrendezve a sejtfelületen keresztül (E. coli).
Vannak olyan fajok, a mikroorganizmusok a mobilitás, de nem csillók (spirocéta, Leptospira). Mozgásuk okozta impulzív csökkentések gépjármű rostos mikrobiális sejtek.
Annak megállapításához, a baktériumok mozgásában van szükség, hogy egy kultúra legfeljebb napos, mint a régi kultúrák elveszti a képességét, hogy mozogni.
Meghatározása bakteriális motilitás a „függő csepp”. Dobd a fiatal (18-20 óra) tenyészetének baktériumok bakteriológiai hurok alkalmazzák a fedél üveg. Különleges tárgylemezre egy mélyedés (lune) van borítva egy csepp kultúra, így a fedőlemez egy csepp volt a központja a félhold, és beragadt a slide (pre-lune széle enyhén bekent vazelinnel). Előállítás fordított üveg fel és dobja „lóg” alatt a félhold (ábra. 8). Előállítás mikroskopiruyut elsötétített látómezőt először alacsony, majd közepes vagy nagy nagyítással. A világos háttér mikrobák sötétszürke. Shukevich módszer. Erre a célra, egy csepp baktérium szuszpenziót úgy alkalmazzuk, hogy a kondenzátum lesarkított szilárd táptalajon in vitro. Mozgékony mikroorganizmusok a mozgó kondenzátum nőnek a tápközeg felszínén; mozdulatlan fajok szaporodnak csak a kondenzátum a közeg ( „nem jön”, hogy a felszínen a agar).
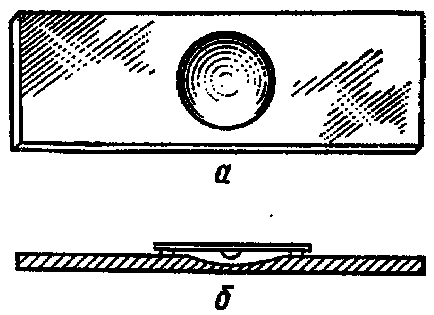
Ábra. 8. A vizsgálat mikrobák a mobilitás és - üveget egy félhold; b - „függő csepp”
„Zúzott drop” módszerrel. Egy csepp baktérium szuszpenzió alkalmazható egy hagyományos mikroszkóp tárgylemezre, és óvatosan fedjük le egy fedél üveg és óvatosan nyomja le az ujjával. Mikroszkóp végeztük, valamint a módszer „függő csepp”.
vetés eljárás prick félszilárd agar. Ehhez és bakteriológiai kacs beoltott tenyészetet a tanulmányozott megszúrja a cső fenekére egy félig-folyékony tápközegben. A mozgatható kultúra növekszik az egész közegben, alkotó egységes turbiditás, és rögzített - megszúrja csak rúdként van kialakítva, miközben az átláthatóságot oltás nélkül közegben.
5. leckében Laboratórium és annak előkészítése. Tápanyag médiában. Előállítási eljárásai és sterilizálása táptalaj. A sterilizációs eljárásokat a laboratóriumi üvegáru.
A cél a képzés. Elkészítéséhez az edényeket. Készítsük el a táptalaj. Határozza pH-jú környezetekben. Ismeri a módszereket sterilizálása táptalajok és laboratóriumi üvegáru.
Berendezés és anyagok. Háromlábú, csövek, mikrobiológiai hurok, pipetták, Petri-papír. Autoklávok sütőben. Állítsa környezet és vegyi anyagok. pH-mérő.