Ionos jellege kovalens kötések 1
A molekulák áll két azonos atomok, mint például, H2 vagy Cl2, mindig tisztán kovalens vegyületek. Azonban, amikor egy kovalens kötés csatlakoztatott két különböző atomok, a kötő elektronok közötti megosztásának őket egyenlőtlenül. Ez annak köszönhető, hogy a képességét, két egyenlőtlen atom, hogy vonzzák a elektronokat. Az eredmény egy poláris kovalens kötés. Ezt a kapcsolatot az jellemzi, az egyik atom egy kis pozitív töltés, és a másik kis-atom a negatív töltés. Kommunikáció a két egymással szemben a jele a töltés elektromos dipólus. A díjakat a dipól kijelölt 5+ 5 -. Symbol 5 jelzi, hogy a terhek kicsi (kevesebb, mint a töltés az elektron). A kvantitatív elektromos dipólus a termék a távolság a két díjak a díj összegének ilyen termék az úgynevezett elektromos dipólmomentum.
A mennyisége díjak felmerülő képződése során poláris kovalens kötés függ a különbség a képessége, hogy vonzza az elektronokat a két kötődő atomoknak egy kovalens kötés. Az a képesség, hogy egy atom vonzza az elektronokat nevezzük annak elektronegativitása. Számszerűsíteni elektronegativitási javasolt több mérleget. A leggyakrabban használt elektronegativitási skála által javasolt Pauling. Építési ennek skála alapul kísérleti értékek a entalpiája a kötés képzésében a kétatomos molekulák.
Elektronegativitása a periódusos rendszer elemeinek egymás utáni növekedése, amikor mozog balról jobbra mentén minden egyes időszakban. Minden csoporton belül (kivéve egy része elemeinek III) elektronegativitási szekvenciálisan csökken, amikor lefelé mozog. Táblázat. 2.2 elektronegativitási felsorolt néhány elem által kiszámított Pauling. A Pauling elektronegativitása skálán fluort (a legtöbb elektronegatív összes elem) hagyományosan tekinteni, hogy az 4.0. Megjegyezzük, hogy a elektronegativitási dimenziótlan.
Íme néhány példa arra, hogyan kell használni a táblázatban szereplő adatok. 2.2, hogy értékelje az ionos jellegét a kovalens kötés.
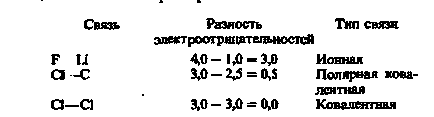
Minél nagyobb a különbség a elektronegativitása, annál nagyobb az aránya a ionos jellege, vagy a mértéke iontartalma a kötés. A különbség a electronegativities egyenlő 2,1, ami megközelítőleg 50% -os ionos jellege. Mivel a különbség elektronegativitási nagyobb 2.1 lehet tekinteni ion. Mivel a kisebb különbség elektronegativitási közé tartoznak a poláris kovalens kötés. A kisebb elektronegativitás különbség, annál kisebb a mértéke iontartalma a kötés. Nulla elektronegativitási különbség jelzi, hogy nincs ionos jellege, és így tisztán kovalens kötés.
A pozitív töltés a kation az ionos vegyület vonzza az elektronokat a szomszédos anion. Ez vezet torzulásához az elektron felhő anion (lásd. Ábra. 2.11). Ez a torzítás az úgynevezett polarizációs. Az a képesség, hogy vonzza az elektronokat kation és anion polarizációja nevezzük polarizáló képességét. A mértéke ionos kötést olyan intézkedés a polarizációs foka a kovalens kötés. Elektronsűrűség térképek tisztán ionos vegyületek, mint például a lítium-fluorid, nem érzékeli a torzítás.
1923-ban, K. Agyag azt javasolta, hogy az összes vegyületek azzal jellemezhetők, bizonyos fokú kovalenciája. Azt is javasolta, hogy az ionos polarizáció
Ez a három szabályok hívják szabályait fajansz.