Laboratóriumi módszerek termelő bázist
Laboratóriumi módszerek előállítására szubsztrátok.
Library / Okok / Library / Okok / laboratóriumi előállítására szolgáló eljárások felületeken. Laboratóriumi módszerek előállítására szubsztrátok.
A laboratóriumi körülmények között, a bázist úgy állítjuk elő kis mennyiségben, nem több, mint 100-200 gramm. Néha több, attól függően sajátos szükségleteit laboratóriumok az anyagban. De ezek az összegek kicsik. A nagy mennyiségben alapja a kémiai technológiai laboratórium képes csak azokban az esetekben, amikor teljesítette elkészítési módja ennek az anyagnak az ipar számára.
Tekintsük az alapvető módszerek megszerzésének hidroxid a laboratóriumban.
A laboratóriumban, hogy megkapjuk alkálifém-hidroxidot alkalmazunk két módon. Az első és a legdrágább, a közvetlen reakció az alkálifémek vízzel, ahol a lúg kapott. Ez a módszer használható a NaOH, KOH, LiOH, Ca (OH) 2.
Ezek a reakciók igen veszélyes, mert a használata az aktív fémek: nátrium, kálium, lítium. Nem lehet használni ezekben a reakciókban nagy mennyiségű alkálifémek, akkor gyullad meg, és még felrobban.
Laboratóriumi körülmények között alkalmaztak és egyszerűsített módszerek az ipari termelés a nátrium-hidroxid. Miért nátrium-hidroxid. mert ez a legelterjedtebb az összes hidroxidok kémia és az ipar. Ahhoz, hogy azt egy elektrolízis módszerrel. Reakcióvázlat áramlási elektrolízis egység indukálódik a 2. ábrán.
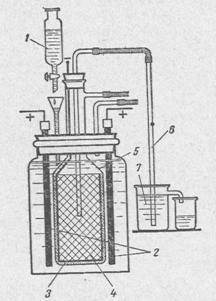
2 - anódok a gráf-ta;
3 - egy membrán azbeszt fedélzeten;
4 - a katód formájában egy henger alján egy vas vagy acél szita;
5 - üvegharang;
6 - egy szifon elmozdulását a katód kamra oldat;
7 - csésze fogadására alkálifém.
A végén a grafit anódok kiálló az oldat felett kell előre impregnált olvadt paraffin, az elektrolit nem emelkedik a kapillárisokon keresztül, és nem pusztult el érintkező réz. Kapcsolat rézhuzal grafit anód végezzük réz kupakkal szorosan kikészített, hogy az anód, illetve szűk kanyargós rézdrót a lecsupaszított végét az elektróda. A katód acél vagy drótháló. Meg kell a felső szorosan illeszkedik az üveg harang, hogy a hidrogén ne kerülhessen be az anódtértől. Azbeszt, előre megnedvesített vízzel, azzal a kiegészítéssel, igen kis mennyiségű szilikát ragasztó alkalmazni, mint a zagy a külső a vas-háló (vastagság 5-10 mm). Miután a azbeszt száraz, lehet kissé lángra annak érdekében, hogy továbbra is erős membrán és az elektrolit. A szükséges előtolás és elektrolit túlfolyó érjük választótölcsér segítségévei egy csapot, az 1. ábrán látható.
A klór és a hidrogén előállítására használható szintetikus sósavat. E célból be vannak táplálva az égő, amely egy pohár tee töltött szilikagél.
Az effluenst az elektrolit oldatot bepároljuk egy porcelán tálba. Időről időre egyesült a csapadékot só folyékony rész, a végén a párolgási a hőmérsékletet úgy állítjuk be, hogy 500 ° C-on keverjük, egy alkáli-olvadékot lehűtjük, összetörjük és tárolni egy zárt üvegedényben. Teljesen tiszta lúgot lehűtésével kapott egy 35 százalékos nátrium-hidroxid oldatot, hogy a műszaki 5 ° C A kristályokat esnek NaOH × 2H2O és NaOH × 4H2O, amely elkülönül az oldatból és kalcináljuk.
Ezzel azonos beállítási lehet készíteni, és a kálium-hidroxid és lítium-hidroxid. Kézhezvételét követően lúgok hogy ezt a szerelési meg kell, hogy különleges intézkedéseket az óvatosság, mert az egyik az elektrolízis termékeinek klór.
A nátrium-hidroxid-néha még idősebb módszert alkalmazzuk - forrásban lévő szóda oldatot hidratált mész:
A reakció befejeződése után az oldatot dekantáljuk a kalcium-karbonát csapadék és víz elpárologjon, a kapott fuzionált nátrium-hidroxid.
Elég gyakran, elvégzéséhez kémiai reakciók laboratóriumokban kell szereznie oldhatatlan hidroxidok, mint például hidroxidok réz, cink, kobalt, kadmium, nikkel. Ezek előállításához használja a reakció a vízben oldható sók e fémek nátrium-hidroxiddal. A kölcsönhatás természetének ezt a választ kapcsolódik a csere reakciók.
Réz-hidroxid (kék) és nikkel-hidroxid (zöld - kék) beleesik az üledéket. Szűrés után az oldat és a csapadék mosása, fel lehet használni a kémiai folyamatokban. Így a kapott hidroxidok réz (II), cink, kobalt, kadmium, higany (II), ón, ólom, mangán, titán, króm, és sok egyéb fémek.
Lásd még:
Polymeranalogous átalakítása sztirol-butadién gumi
Alatt a reakció a polimer megértse kémiai átalakításokat alkotott makromolekulákból előre. Ezek a reakciók, miközben, növekvő vagy csökkenő a polimerizáció foka.
A modern irányzatok és új trendek a polimer tudomány
A modern irányzatok és új trendek a polimer tudomány egyértelműen szemléltetik által végzett kutatás az orosz Alapítvány Basic Research (RFBR) Jelenleg.