Móltömeg a fluor- (F), példák általános képletű és
A moláris fluor tömegének
Móltömeg (M) egy anyag olyan érték arány egyenlő a a tömegét a megfelelő szer. A moláris tömeget lehet kifejezni g mólonként (g / mol):
ahol m - tömege grammban; n-számú anyag mólokban.
Móltömeg - esetében, mindegyiknél állandó kémiai elemet vagy vegyületet. A számértéke a móltömeg egybeesik a számértéke relatív molekulatömegű anyag (Mr - egy szám jelzi, hogy hány alkalommal a tömeg a molekula már 1/12 tömeg szénatom) vagy egy érték relatív atomtömege elem (hányszor az átlagos súlya atomok kémiai elemek nagyobb, mint 1 / tömege 12 szénatomos).
A relatív atomi tömege 18,9984 atomi fluor- amu A relatív molekulatömege egyenlő 18,9984 moláris tömege:
M (F) = úr (F) × 1 = 18,9984 mol g / mol.
Köztudott, hogy a fluor kétatomos molekula - O2. Ezután a relatív atomtömeg fluor molekulák lesz egyenlő:
Ar (F2) = 18,9984 × 2 = 37,9968 amu
A relatív molekulatömege fluort molekulák egyenlő lesz 37,9968, és a móltömeg:
M (F2) = úr (F2) × 1 = 37,9968 mol g / mol, vagy csak 38 g / mol.
A fluor gáz halványsárga színű (atomi szerkezetének ábrán látható diagram. 1.). Mérgező. Alacsony koncentrációban fluort szag emlékeztet a szaga ózon és klór egyszerre.
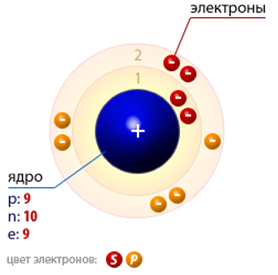
Ábra. 1. Szerkezet fluoratom.
Kiszámításához molekulatömegű anyag gáz halmazállapotú lehet használni, és más utak, például, hogy végezzen a számítás az alábbi egyenlettel Mendeleev-Klaypeyrona, erre a célra használt, egy moláris térfogata vagy a gáz sűrűsége viszonyítva bármely más gáz.
Példák problémák megoldása
Számítsuk ki a relatív sűrűsége a levegő fluor és a hidrogén-fluorid.
Ismeretes, hogy a sűrűsége a levegő vagy gáz kerül kiszámításra az arány a moláris tömege a gáz moláris tömegét levegő (29 g / mol):
Móltömeg molekuláris fluort 38 g / mol, és a hidrogén-fluorid - 20 g / mol. Ezután a sűrűséget a fluor és a hidrogén-fluorid egyenlő lesz a levegő:
Dair (HF) = 20/29 = 0,6897.