Az irány kémiai reakciók
I. főtétele lehetővé teszi, hogy kiszámítja a hőhatás a különböző folyamatok, de nem nyújt információt a folyamat áramlás irányát.
A természet a folyamatok játszódnak le az ismert két hajtóerő:
1. A vágy, hogy mozgatni a rendszert egy olyan állapotba a legalacsonyabb energia-tartalom;
2. Az aspirációs rendszer révén a legvalószínűbb állapot, amelyre jellemző a maximális számú független részecskék.
Az első tényező jellemzi változás entalpia. Ez az eset csatolni kell a hőtermelés, ezért a DH <0.
A második tényező határozza meg a hőmérséklet, és a változás az entrópiában.
Entrópia (S) - funkciója a termodinamikai állapotát a rendszer, amely tükrözi a valószínűsége, hogy egy adott állapot során a rendszer a hőcserélő.
Csakúgy, mint az energia, entrópia nem vonatkozik száma kísérletileg meghatározott értékek. Egy reverzibilis folyamat előforduló izoterm körülmények között, az entrópia változása lehet kiszámítani a következő képlet segítségével:
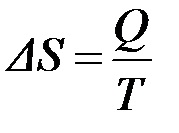
ami azt mutatja, hogy a dimenziója entrópia J / K vagy J / (mol × K).
A visszafordíthatatlan folyamatokat a következő egyenlőtlenség:
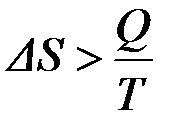
Ez azt jelenti, hogy az áramlás a visszafordíthatatlan folyamat, az entrópia következtében nő az átmenetet a hő a munka egy részét.
Így a rendszer elvégzi a munkát a lehető legnagyobb visszafordítható folyamatokat. Amikor egy visszafordíthatatlan folyamat, a rendszer mindig egyre kevesebb munkát.
Daylight elvesztette munkáját, hővé egy jellemzője hőt makroszkóposan rendezetlen energiaátadás formájában. Ezért értelmezése az entrópia az intézkedés a zavar a rendszerben:
A növekvő zavar a rendszer entrópia növekszik, és fordítva, az entrópia csökken a rendelési rendszer.
Így, a folyamat a víz párolgása entrópia növekszik a kristályosodás során a víz - csökken. A reakciók a lebomlás nő entrópia reakciókban vegyületek - csökken.
A fizikai jelentése entrópia létrehozott statisztikai termodinamika. Szerint a Boltzmann-egyenlet:
.
ahol k - Boltzmann állandó egyenlő 1,38 × 10 - 23 J × K - 1,
W - hányféleképpen, hogy a rendszer végzi macrostate. Az érték W is nevezik termodinamikai valószínűsége.
Az entrópia statisztikus értelmezése azt jelenti, hogy ellentétben az energia, amely elválaszthatatlan az egyes részecskék, entrópia tükrözi a tulajdonságait egy sor részecskék. Külön részecske nincs entrópia.
Ha a folyamat visszafordítható az izobár-izoterm körülmények között, a következő összefüggéseket kell teljesíteni: