Általános jellemzők enzimek
I. Fermenty- biológiai katalizátorokat protein jellegűek, képesek gyorsuló kémiai reakciók többször előforduló vorganizme, de ezek nem képezik részét a reakció végtermékei.
Olyan anyagok, amelyek hat nevezett enzim szubsztrátok.
Minden különböző biokémiai reakciók előforduló mikroorganizmusok, növények és állatok katalizálja a megfelelő enzimek. A szerepe az enzimek élelmiszeripari technológia. Az alapot a termelési bármely élelmiszertermék hazugság vagy biokémiai (enzimatikus) vagy fizikai-kémiai folyamatok, vagy a folyamatok vannak kapcsolva.
Ellentétben a szervetlen katalizátorok, enzimek megvannak a saját jellemzői:
Ø aránya enzimes katalízis több nagyságrenddel nagyobb (a március 10-szeptember 10), mint a nem-biológiai katalizátor;
Ø hatására mindegyik enzim nagyon specifikus, azaz mindegyik enzim hat csak egy hordozón vagy egy csoport a kapcsolódó szubsztrátok;
Ø enzimek kémiai reakciókat katalizáló enyhe körülmények között, azaz a környezeti nyomáson, magas hőmérsékleten (20-50 ° C) és a pH-értékek a közeg, a legtöbb esetben közel semleges.
Ami a lokalizációja enzimek a sejtben vannak osztva extracelluláris és intracelluláris.
Az extracelluláris enzimek szekretálja egy élő sejt, hogy a külső környezet, intracelluláris - amelyek vagy sejtszervecskéket, vagy kombinációban szupramolekuláris szerkezetek.
Egy speciális csoportját az enzimek alkotják sokenzimes komplexek, amelyek számos olyan enzimek, amelyek katalizálják az egymást követő reakciók konvertálása minden szubsztrát. Ezeket a komplexeket lokalizálódnak intramolekuláris struktúrák úgy, hogy minden enzim található a közvetlen közelében az enzim reakciót katalizáló az áramkörben Ezen reakciólépések. Köszönhetően ez az elrendezés enzimszubsztrátot diffúzió és reakciótermékek minimalizálható.
II. Enzimek - magas fehérjetartalmú vegyületek.
Mint más fehérjék, enzimek 4 szint a szerkezet, úgy az összes fizikai-kémiai tulajdonságai a fehérjék, és csak egy megkülönböztető jellemzője - a képesség, hogy gyorsítsa a kémiai reakciók. Enzimek lehet egyszerű - egykomponensű és kétkomponensű komplex.
Egykomponensű enzimek - beépített polipeptid láncok, és csak az aminosavak elbomlanak hidrolízis.
Kétkomponensű enzimek - állnak a protein rész - apoformenta és a nem-fehérje részek - kofaktor. Mindkét összetevő külön-külön nincs enzimatikus aktivitása. Csak egyesítésével (holoenzimet) megszerzik a jellemző tulajdonságok biokatalizátorok. Role kofaktor végezhet bármilyen ion (Zn 2+. Mg 2+. Fe 2+. Cu 2+. Kevesebb K + és Na +) vagy szerves vegyület (vitaminok, nukleotidok). Kofaktorok szerves természetű nevezzük koenzimek.
típusú kapcsolat a kofaktorként apoenzimmel eltérő lehet. Egyes esetekben, ezek különálló és csatlakozik csak idején a reakció; más esetekben a koenzimet és apoenzimmel jár állandóan, néha erős, a kovalens kötés.
Az aktív helyén enzimek egy helyi régióban egy molekula az enzim, amely részt vesz a cselekmény katalízis. Az egykomponensű fermentahaktivny központ van kialakítva a sajátos orientációja aminosavak a polipeptid-lánc. Általában úgy kialakulását kisszámú aminosav vesz részt a 12-16. A funkciós csoportok az ezen aminosavak is tartozhat linkek a polipeptid-lánc, egymástól távol. A konvergencia társított kialakulását enzimek tercier szerkezetében.
A kétkomponensű enzimek aktív centrumában egy komplex a kofaktor és néhány szomszédos aminosav maradékok.
Az aktív centrum megkülönböztetni csap (anchor) része van, amelynek funkciója - a szubsztrát kötésében, és egy katalizátor - ahol a konverziót a szubsztrát a reakció termékek után kötődés az érintkező rész. A formáció a ezeken a területeken a következő funkcionális csoportok részt: COOH csoportok vagy dikarbonsav amino-végcsoportok a polipeptid-lánc; imidazol-csoport a hisztidin; OH-csoport, a szerin; NH2 - csoport lizin és a terminál csoportok a polipeptid-lánc; a fenolos csoport tirozin és a hidrofób maradékok alifás aminosavak.
III. Bármilyen enzimatikus reakció sebességét úgy határozzuk meg, egy energia gáton. amely szükséges leküzdeni a reagáló molekulák. Szerint Arrhenius, egy kémiai reakció szempontjából az energia a folyamat által leírt egyenlettel
ahol N - számú aktív molekulák; N0 - az összes reaktáns molekulák; e - a bázis a természetes alapú logaritmus; R - gázállandó; T - abszolút hőmérséklet; EAKT - aktiválási energia.
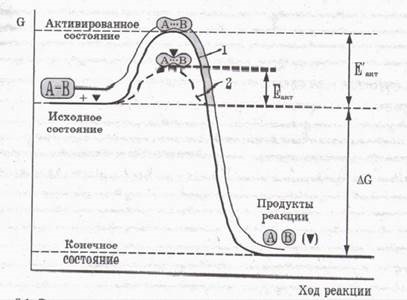
A legfontosabb funkciója az enzim - katalizált csökkentése az aktiválási energia a pro-CES-sa. Ábra. 1. ábra egy grafikon, a változás az energia nem-enzimatikus (1) és az enzimatikus (2) reakciók. Az enzim csökkenti a magassága a energia-ti-ügynökség gát (EAKT <Е¢акт ).
Fermi mechanizmus tativ-katalízis Egyelőre nem világos, sok tekintetben. Azonban, a fő szerepet a létrehozásában enzimkinetika játszott M. Michaelis és M. Menten, amelyben az ötlet az enzim-szubsztrát komplex alakult. A formáció ebben az összetett és csökkenéséhez vezet az aktiválási energia.
Process enzimatikus osztható három lépésből áll:
1. S sztérikus szubsztrátkötő aktív helyéhez Fer-ment E (az enzim-szubsztrát komplex ES).
2. átalakítása az elsődleges komplex aktivált ES
Átmeneti komplex ES ≠.
3. szétválasztása a végtermék F a enzimreakció.
Az első szakaszban a rövid időtartamú, a koncentrációtól független enzim és a szubsztrát a közegben, a diffúzió sebessége a szubsztrát az aktív hely az enzim. A komplex képzésére az ES-tanítás frissítheti magukat különböző kombinációkban, mint egy kovalens, koordinatív, ionos kötés és a forma kevésbé stabil kötéseket - az elektrosztatikus vonzás a poláris csoportok, a van der Waals kohéziós erők közötti nem-poláris molekuláknak részek hidrogénkötések. A természet e kötések miatt a kémiai jellemzőit és a szubsztrát, és a funkciós csoportok az aktív oldalon az enzim.
A második szakaszban, sőt, jár katalízis, azaz okmány törés, vagy új kapcsolatok kialakítását a szubsztrát; ez a leglassabb és korlátozza a sebességet a kémiai reakció. Ebben a szakaszban, és csökkenti a aktiválási energia az enzimatikus reakció kialakulását az aktív átmenetifém komplexet ES ≠.
Molekuláris szinten, világosabb megértése a hatásmechanizmusa enzimek ad az elmélet a sav-bázis katalízis. Bármely reakció megy megtörése a kovalens kötések, magában foglalja a két szemben lévő komponensek elektronikus jellegű-Ing. Az elektronok szakadt miatt van szükség, hogy egy jó ideje elektro-philous komponenst és megy a nukleofil. Reagensek, Koto-rozs lehet meghatározni, mint az elektronikus tuning - egy sav és egy bázis. Azonban, egy és ugyanazt a megoldást, hogy hozzon létre egy egyidejűleg Menno magas koncentrációban mind a két komponens lehetetlen, poskol-ku semlegesítik egymást. Az enzim fehérje molekulát bla Godard biztosítása a katalitikus helyén elektrofil és a nukleofil csoportok nincs közvetlen semlegesítési reakció. Ez valójában meghatározza a cselekmény katalízis. Mivel egy bizonyos távolságra egymástól elektrofil és a nukleofil csoportok a katalitikus hely az enzim nemcsak kötődnek a szubsztráthoz körte-al-csoportok, de van egy erős hatása polarizálva a szubsztrát csoportokban. Ehhez járul még a lehetőségét díjak ingadozása ES komplex, amely megteremti a magas fokú hatékonyságot a polarizáció. Ez az oka annak, hogy a csökkenés az aktiválási energia a enzimatikus.
Összhangban az elmélet a kovalens katalízis néhány fer-Ments kölcsönhatásban vannak a szubsztrátok, alkotó instabil kovalensen kötött enzim-szubsztrát komplexek. Ezekből comp-Lex a következő reakciókban, a reakciótermékek képződnek, mint amikor-is sokkal gyorsabb, mint abban az esetben, nem katalizált reakciók.
Így, a harmadik szakaszban, amelynek végén a képződését reakciótermékek által biztosított folyamat fut a pre-átadó szakaszok.