Molekulatömeg etilén (c2h4), képlet és példák
Az etilén molekulatömege
Az etilén (etén) egy szerves természetű összetett anyag, amely az alkén-osztály homológ sorozatának (telítetlen / telítetlen szénhidrogének egy kettős kötéssel) előde.
A molekula szerkezetét az 1. ábrán mutatjuk be. 1. Normál etilén körülmények között színtelen gyúlékony gáz, halvány szaggal. Sűrűség - 1.178 kg / m 3. Vízben rosszul oldódik.
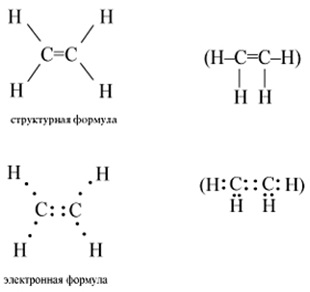
Ábra. 1. Az etilén molekulájának szerkezete.
Az etilén bruttó formula C2H4. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Mr (C2H4) = 2 × 12 + 4 × 1 = 24 + 4 = 28.
A moláris tömeg (M) 1 mól tömegű anyag. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy az etilén móltömege 28 g / mol.
Példák a problémamegoldásra
A mangánvegyület képletét oxigénnel írjuk, ha az elemek tömegfrakciói: ω (Mn) = 63,2%, ω (O) = 36,8%.
Az X elem tömegtörzsét a HX kompozíció molekulájában a következő képlet segítségével számítjuk ki:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük az összetevők "x" (mangán) és "y" (oxigén) összetevők móljainak számát. Ezután a mólarány így fog kinézni (a DI Mendeleev periódusos táblázatából vett relatív atomtömegek értéke egész számra kerekítve):
x: y = ω (Mn) / Ar (Mn). ω (O) / Ar (O);
x: y = 63,2 / 55. 36,8 / 16;
x: y = 1,15. 2,3 = 1.
Tehát a mangánvegyület oxigénnel képzett formája Mn02 formában van. Ez a mangán-oxid (II).
A hidrogén, a jód és az oxigén kombinációjának képletét, ha az elemek tömegfrakciói: ω (H) = 2,2%, ω (I) = 55,7%, ω (O) = 42,1%.
Az X elem tömegtörzsét a HX kompozíció molekulájában a következő képlet segítségével számítjuk ki:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük az x (hidrogén), y (jód), z (oxigén) vegyületet alkotó mólelemek számát. Ezután a mólarány a következőképpen néz ki (a DI Mendeleyev Periodikus Táblázatából vett relatív atomtömeg értékeit egész számra kerekítve):
x: y: z = ω (H) / Ar (H). ω (I) / Ar (I). ω (O) / Ar (O);
x: y: z = 2,2 / 1. 55,7 / 127: 42,1 / 16;
x: y: z = 2,2. 0,44: 2,63 = 5,1,6.
Ezért a hidrogén, a jód és az oxigén kombinációjának képlete H5 IO6 formájú.