A sejtek öregedésének mechanizmusa és annak szakaszai
A sejtek öregedésének mechanizmusa és annak szakaszai
W. Shakespeare. talán a legjobban, az öregedési folyamatot jellemezte, a hét korszak finom leírását. Minden a koncepció pillanatától kezdődik, majd a szervezet fokozatosan emelkedik, majd a folyamat elkezdődik, ami a test funkcióinak teljes elvesztéséhez vezet, és véget vet a halálnak.
A sejtek öregedésének folyamata a szubletális rendellenességek progresszív felhalmozódása lehet több évig, ami csökkenti a sejtek képességét a károsodásra vagy a halálhoz vezető képességre.
A sejtek öregedése a genetikai rendellenességek és a sejt és a molekulák károsodásának a külső hatások következtében bekövetkező károsodása által okozott fokozatos csökkenésének és életképességének a következménye.
Az öregedés kísérleti modelljeinek vizsgálata lehetővé tette annak megállapítását, hogy az öregedés szabályozott folyamat, melyet korlátozott számú gén és a korai öregedés szindrómái alapjául szolgáló genetikai rendellenességek szabályoznak. Ezek az adatok azt jelzik, hogy az idősödés bizonyos változásokkal függ össze.
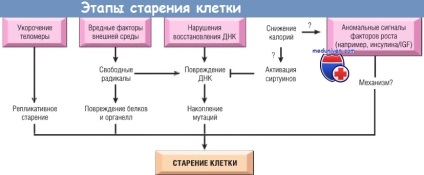
A sejtek öregedését elősegítő változások.
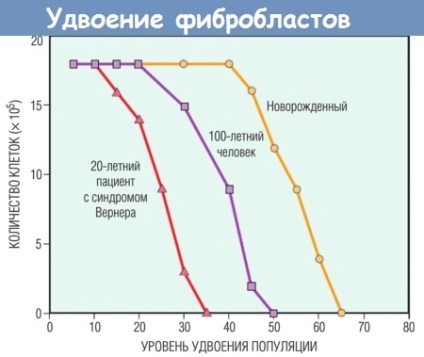
- csökkent sejtreplikáció. Az a koncepció, hogy a legtöbb normális sejt korlátozott replikációs képességgel rendelkezik, kifejlesztésre került az öregedés egy egyszerű kísérleti modelljének tanulmányozása során. A normális humán fibroblasztok, ha szövettenyészetbe kerülnek, korlátozott hasadási potenciállal bírnak.
Egy meghatározott számú osztódás után az összes szomatikus sejt a terminális szétterjedési állapotban marad, élettani öregedésnek nevezik. A gyermekek sejtjei többszörös replikációs körökön mennek keresztül, mint az idősek sejtjei. A Werner-szindrómában szenvedő betegek sejtjei (a korai öregedés jelei által jellemzett ritka betegség) a DNS-replikáció megszegése és a szétválasztás jelentősen korlátozott képessége.
Még mindig nem ismert, hogy miért kapcsolódik a test elöregedése a sejtek progresszív öregedésével. Talán ez azért van, mert a sejtosztódás kromoszóma végeinek (telomere-rövidítés) hiányos replikációjával jár, ami végül a sejtciklus megállításához vezet.
A telomerek - rövid, ismétlődő DNS-szekvenciák (TTAGGG), végén elhelyezkedő lineáris kromoszómák, biztosításához szükséges a teljes replikációját a kromoszómák végéhez, és megvédje őket a fúziós és a degradáció. A szomatikus sejtek replikációja során a telomerek egy kis része nem duplázódik meg, és a telomerom sokkal rövidebb lesz. Ebben a tekintetben a kromoszómák végeit törött DNS-nek tekintik, amely aktiválja a DNS károsodásra adott reakciót és a jelet a sejtciklus megállítására.
Általában a telomer hosszúságát a telomeráz enzim nukleotid hozzáadásával tartjuk fenn. A telomeráz egy sajátos RNS-fehérje komplex, amely saját RNS-t alkalmaz, nukleotidok hozzáadására a kromoszómák végeire. A telomeráz aktivitása gátolja a szabályozó fehérjéket, amelyek szabályozzák a telomerek hosszát és szükségtelen hosszabbítást vágnak le. A telomeráz aktivitása csírasejtekben magas, és az őssejtekben jelentéktelen mértékben jelen van, de szomatikus sejtekben gyakorlatilag hiányzik.
Mivel a szomatikus sejtek szétválásában telomerjeik rövidebbé válnak, a sejtek elhagyják a sejtciklusot, ami az új sejtek megszerzésének lehetetlenségéhez vezet a sérültek helyettesítésére. Így a régi sejtek felhalmozódása és az őssejtek medence kimerülése az öregedő sejtek következtében hozzájárul az egész szervezet öregedéséhez. Másrészt ismeretes, hogy a telomeráz tumorsejtekben aktiválódik, és a telomerin hossza állandóvá válik. Ez lehetővé tette számunkra, hogy feltételezzük, hogy a hosszúság stabilitása fontos, talán a legfontosabb feltétel a tumor kialakulásához.
Azonban a telomeráz aktivitás és a telomerek hosszúsága az öregedéssel és a daganat növekedésével összefüggő kapcsolat még nem teljesen ismert.
A replikációs öregedést a pl6 / INK4a sejtciklus-inhibitor fokozott kifejeződése és a DNS károsodása is indukálhatja (lásd alább). Nem ismeretesek ezek a tényezők a normális öregedési folyamatban;
- az anyagcsere és a genetikai károsodás felhalmozódása. A sejt élettartama függ a károsodástól a sejtben végbemenő anyagcsere folyamatok és a védő molekuláris válaszok okozta károsodások közötti egyensúlytól. Az aktív oxigénformák a normál metabolizmusú toxikus termékek csoportja.
Az oxidatív foszforiláció melléktermékei a fehérjék, lipidek és nukleinsavak kovalens módosítását okozzák (lásd korábban). Fokozott oxidatív károsodás lehet ismételt kitettség eredményeként a külső tényezők (például ionizáló sugárzás) és a mitokondriális diszfunkció vagy csökkenést az öregedési antioxidáns védelmet biztosított, mint például E-vitamin, glutation-peroxidáz.
Az oxidatív károsodás mennyisége. a korral növekvő, fontos öregedés oka lehet. Ezt a tényt az alábbi észrevételek is alátámasztják:
(1) a különböző organizmusformák élettartama fordítottan korrelál a mitokondriumok által termelt O2 szintekkel;
(2) az antioxidáns enzimek túlzott kifejeződése, a SOD és a kataláz prolungálja a Drosophila légy transzgenikus formáinak élettartamát. A szabad gyökök hátrányosan befolyásolhatják a DNS-t, ami a genom bomlását és instabilitását eredményezi, ezáltal befolyásolja a sejtfunkciókat.
A védő válaszok ellensúlyozzák a sejtek fokozatos károsodását. a legfontosabb a sérült DNS javítása. Bár a DNS-károsodást elsősorban az endogén, DNS-javító enzimek helyreállítják, ezek közül néhányan a sejtekben akkumulálódnak. A DNS-javítás fontossága az öregedési folyamatban bizonyított.
Azoknál a betegeknél, Werner-szindróma (egy korai öregedés szindrómák) gén termel defektív DNS helikáz - egy fehérje részt vesz a replikációban és a DNS-javítás és egyéb folyamatok során a letekercselés DNS. Ennek az enzimnek a hiánya a kromoszómák károsodásának gyors felgyülemlését okozza, ami szimulálja a károkat, általában az öregedéskor. Genetikus instabilitása szomatikus sejtek az is jellemző egyéb rendellenességek, amelyekben a beteg mutatja az öregedés jeleit, mint például ataxia-telangiectasia, amelyben a mutáns gének által kódolt proteinek a javítás a DNS kettős szálú törések.
Így a kumulált anyagcsere-károsodás és a válaszváltozás közötti kapcsolat meghatározhatja egy személy öregedési arányát. Ebben a forgatókönyvben az öregedés késleltetheti a károk felhalmozódásának csökkentésével vagy a válaszadás erõsítésével.
Korral nem csak a DNS károsodása kumulálódik. hanem sejtes organellákat is. Részben ez a proteaszóma funkciójának csökkenését eredményezheti, megszüntetve a rendellenes és nem kívánatos intracelluláris fehérjéket.
Az organizmusok (az élesztőtől az emlősökre) végzett vizsgálatai azt mutatták, hogy az élet meghosszabbításának leghatékonyabb módja a kalória csökkentése. Ennek mechanizmusa még mindig ismeretlen, de a kalóriák hosszú élettartamra való csökkentésének hatása valószínűleg egy sirtuin-fehérje család közvetítésével jár. A szirtinok hiszton dezacetiláz aktivitással rendelkeznek, és úgy vélik, hogy több gén kifejeződését okozzák, amelyek termékei növelik a várható élettartamot.
Ezeket a termékeket fehérjék képviselik. amelyek növelik az anyagcsere-aktivitást, csökkentik az apoptózist, stimulálják a fehérje összecsukását és gátolják a ROS káros hatásait. A szirtuins szintén növelik az inzulinérzékenységet és a glükóz metabolizmust, és célpontok lehetnek a cukorbetegség kezelésében. A borbarátok örömmel hallják, hogy a vörösbor összetevői aktiválják a szirtuinokat, ezáltal meghosszabbítják az ember életét.
Más kutatók azt találták, hogy ilyen növekedési tényezők. mint inzulinszerű növekedési faktor, és a sirtuins által indukált intracelluláris jelátviteli utak is befolyásolják a várható élettartamot. Az inzulinreceptorokból származó jelek által aktivált transzkripciós faktorok géneket idézhetnek elő, amelyek lerövidítik az életet, így az inzulin receptorok mutációi meghosszabbítják. Jelenleg mindezek a kérdések az aktív kutatási területek.
A celluláris változások különféle formái és az adaptív reakciók. Ezek széles körét ölelik fel a - alkalmazkodva a méret a sejtek növekedését és funkcióit, reverzibilis és irreverzibilis sejtkárosodás és apoptózis, patológiás változások a sejt organellumok és intracelluláris felhalmozódását, beleértve a pigmentáció. Ezeket a változásokat a betegségek klinikai leírása a következő fejezetekben említi, mivel Minden szervkárosodás a sejt szerkezetének és funkcióinak változása miatt következik be.
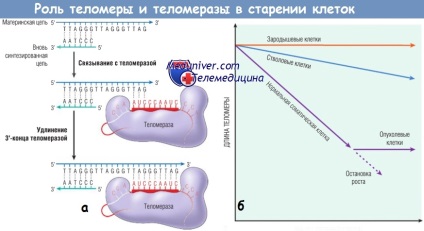
(A) A telomeráz RNS-függő DNS-szintézist irányít, amelyben a kromoszóma végén egy láncba nukleotidokat adnak. Az újonnan szintetizált láncot DNS polimerázzal egészítjük ki.
(B) A telomerek / telomeráz hipotézis és a sejtek proliferatív kapacitása.
A telomerens hossza ellentétes a sejtosztódások számával. Mind a germinális, mind az őssejtek telomerázot tartalmaznak, de csak a csírasejtek jelentős mértékben tartalmazzák ezt az enzimet, hogy teljesen stabilizálják a telomerének hosszát.
A normál szomatikus sejtekben a telomeráz nem aktív, a telomerek minden egyes későbbi sejtosztódással lerövidülnek, amíg a sejt a sejtciklus leállásának fázisába vagy öregszik.
A telomeráz tumorsejtekben való aktiválása a telomerek rövidítéséhez vezet, és korlátozza a normál szomatikus sejtek osztódási képességét.