Plazma lipoproteinek
A lipoproteinek fő funkciója a lipidek szállítása a szervezetben.
A lipoproteinek alábbi osztályai vannak:
-lipoproteinek vagy HDL, a papír elektroforézissel vándorolnak együtt α-globulinokkal. A HDL gazdag fehérjében és foszfolipidekben gazdag.
-lipoproteinek vagy LDL-nek megfelelnek, megfelelnek a p-globulinok mobilitásának. Koleszterinben gazdagok.
Az előlipoproteinek vagy a VLDL a lipoproteinogramon helyezkednek el az a-lipoproteinek között. Az endogén trigliceridek fő szállítási formája.
A hilomikronok - a papír elektroforézisével sem a katódra, sem az anódra nem mozognak, az elején maradnak. A mikomikronok az exogén trigliceridek fő transzport formája.
Számos betegség esetén a vérszérum lipoprotein spektruma megváltozik. A lipoprotein spektrumban 5 különböző rendellenesség volt.
IV. Típus - hiperpreipoproteinémia. Növekszik a VLDL szint, az N-LDL, az XM hiánya. Növekedett TG szint normál vagy enyhén emelkedett koleszterinnel. Klinikailag kombinált cukorbetegség, elhízás, iszkémiás szívbetegség.
V típus - hiper pre-lipoproteinemia vagy chylomicronemia. A VLDL szintje növekszik, az XM jelenléte. Klinikailag xantomaz, néha latens cukorbetegséggel kombinálva.
A kromoproteinek a fehérjéből és a hozzá kapcsolódó színezett, nem protein komponensből álló komplex fehérjék. A név a görög szóból származik.
A kromoproteinek 3 csoportra oszthatók:
1. Hemoproteinek - protetikus csoportként vasat tartalmaznak.
2. Magnézium - porfirinok.
3. A flavoproteinek - tartalmaznak az izoalloxazinszármazékokat.
A hemoprotein csoport magában foglalja a hemoglobint és származékait, a mioglobint és az enzimeket - a citokróm rendszert, a katalázot és a peroxidázt.
Valamennyi kromoprotein tartalmaz olyan fehérjéket, amelyek összetétele és szerkezete eltér. A nem fehérje komponens szerkezeti hasonlóságú.
A hemoglobinmolekulában a fehérjekomponenst a fehérje globin képviseli, a nem fehérje összetevő hema.
A Globin 4 és 2 alegységből áll. Mindegyik lánc 141 aminosavmaradékot tartalmaz, és - 146.
Minden egyes alegységen belül van egy hidrofób "zseb", amelyben a hem található.
A hem egy sík molekula, amely 4 pirrol gyűrűt és egy hozzájuk csatlakozó vasat tartalmaz:
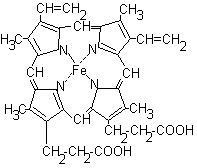
A hem kapcsolódik a protein részhez (globin) a hidroxil-kötésekkel a pirrol gyűrűk és a hidrofób aminosavak között. A globinben lévő hisztidinmaradékok vas-atomja és imidazol gyűrűje között van egy koordinációs kötés. A vasatomnak még egy koordinációs kötődése miatt oxigénmolekula köthető az oxihemoglobin kialakításához.
A hemének a pirrol gyűrűk ugyanabban a síkban helyezkednek el, és a vas atom kiugrik ebből a síkból. Az oxigén hozzáadása "kiegyenesíti" a hemimolekulát: a vas a pirrol gyűrűk síkjához mozog, és ez megváltoztatja a fehérje konformációját. A hemoglobin molekulában 4 protomert tartalmaz, amelyek mindegyike hemént tartalmaznak, és oxigént is tartalmazhatnak. Az első oxigénmolekula hozzáadásával megváltozik a protonkonformáció. Egy protomer konformációjának változása megváltoztatja a fennmaradó protomerek konformációját. A protonkonformáció változása megkönnyíti a fennmaradó oxigénmolekulák kötődését. Ezt a jelenséget kooperatív akciónak nevezik. A hemoglobin affinitása a negyedik O2 molekulánál körülbelül 300-szor nagyobb, mint az első molekulában.
Az oxigén kötődését és átvitelét tartalmazza a tüdőből a szövetekbe. Az oxigén által kötött hemoglobint oxihemoglobinnak nevezik.