Vegyészeti katalógus Aceton
ACETON (a latin acetum - ecetből) (2-propanon, dimetil-keton) CH3COCH3. molekulatömeg 58,079; illékony, színtelen, jellegzetes szagú folyadék; Olvadáspont: 94,6 ° C, forráspont: 56,1 ° C; d4 20 0,7920, nD 20 1,3588; 0,36 mPa * s (10 ° C), 0,30 mPa * s (30 ° C); 0,0237 N / m (20 ° C); 235,5 ° C-ra, 4,75 MPa-t mutat; 749,3 ° C p J / (kmól * K); H ° ISP 29,1 kJ / mól (56,1 ° C) éget -1787kDzh H ° / mol mod N ° - 216,5 kJ / mól ( gáz, 25 ° C) és - 248 kJ / mol (folyadék). Vízzel és szerves oldószerekkel, például éterrel, metanollal, etanollal és észterekkel elegyíthető. Az ACETONE minden kémiai tulajdonsága az alifás. ketonok. Kristályformák. vegyület alkálifém-hidrogén-szulfitokkal, például NaHS03- (CH3) 2C (OH) S03 Na-val. Csak erős oxidálószerek, például KMnO4 lúgos oldat és krómsav, oxidálják az ACETONE-t ecetsavra és hangyasavra, majd CO2-re és vízre. Katalitikusan redukáljuk, hogy izopropanol amalgámok Mg vagy Zn, és a Zn CH3COOH - a pinakol (CH 3) 2 C (OH) C (OH) (CH3) 2. A hidrogénatomok könnyen helyettesíthetők halogénezéssel, nitrozálással és hasonlókkal. A klór és az alkál hatása révén az ACETONE-t kloroformvá alakítják át, amely az ACETON-nal kölcsönhatásba lép, klór-eton (CH3) 2C (OH) CCl3 képződése céljából. antiszeptikusként használják. Az ACETONE oxidálja a szekunder alkoholokat Al-alkoxidok ketonok jelenlétében (Oppenauer reakció):
Belép az aldol kondenzációba, hogy diaceton-alkoholt (CH3) 2C (OH) CH2COCH3 formál. valamint krotonsav kondenzáció kialakulását mezitil-oxid (CH 3) 2 C = SNSOSN3, Forona (CH 3) 2 C = -SNSOSN = C (CH 3) 2, és a mezitilén. Jelenlétében. erős ásványi savak Az aceton alkilálja a fenolt difenil-propán (biszfenol ACETON) (HOC6H4) 2C (CH3) 2 képződésével. cianidiont ad az aceton ciánhidrin (CH3) 2C (OH) CN előállításához. A pirolízis (700 ° C) aceton, ketén CH2-C-O és metán keletkezik.
ACETON elő az iparban elsősorban úgynevezett kumén folyamat egyidejűleg a fenol benzolból és propilén keresztül izopropil-benzol (kumol) séma szerint:
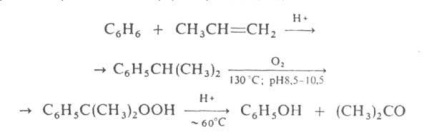
Számos más ind. szintézis módszerek ACETON izopropanolból származik:
1. Oxidáció a gőzfázisban (katalizátor - fémes Cu, Ag, Ni vagy Pt):
Az ACETONE nagy hozama (körülbelül 90%) elérése Ag tölteten horzsolajra vagy ezüsthálóra helyezve.
2. Autokatalitikus oxidáció folyadékfázisban 90-140 ° C-on és 0,2-0,3 MPa:
Az ACETONE hozama az elméleti, 95% -os H2O2 87%.
3. Dehidrogénezés a gőzfázisban ZnO jelenlétében kicsapódva habosán:
Az izopropanol ACETONE-val való konverziójának mértéke 225 ° C-on 84% 380 ° C-98%, 525 ° C-100%. Az aceton hozama körülbelül 90%.
Az új prom. egy eljárás, aceton - közvetlen propilén oxidációs folyadékfázisban jelenlétében Pd-sója PdCI2 vizes közegben, Fe vagy Cu át 50-120 ° C-on és 5-10 MPa:
Az aceton hozama 90%. Egy érték visszatartott Acetonos módszer a termelő fermentálás keményítő hatása alatt baktériumok Bacyllus acetobutylicus, átalakítani keményítő aceton és butanol (az úgynevezett aceton fermentációs). Vannak más módszerek:
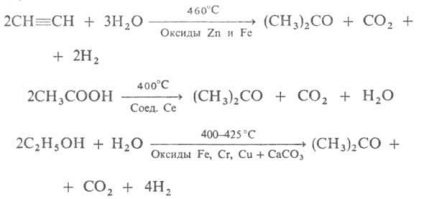
Régi prom. ACETONE-száraz desztilláció (CH3COO) 2 Ca - elvesztése.
A tulajdonságokért. Az ACETONE meghatározások színreakciót alkalmaznak, például dinitrobenzollal, Na nitroprussiddal (Legal reagens); az azonosításhoz - kristályos. az A. származékok, például a semikarbazon (187 ° C olvadáspont). Mennyiségi szempontból az ACETONE meghatározása: 1) oximáció:
A kapott HCi-t titráljuk lúgokkai; 2) titrálással KMnO4 oldattal lúgos közegben (itt az ACETONE oxidálódik CO2-ként és H20-ból). Az ACETONE széles körben használt oldószer szerves anyagok, elsősorban nitrátok és cellulóz-acetátok; viszonylag alacsony toxicitása miatt élelmiszerek és gyógyszerek is használják. ipar ACETON alapanyagaként szolgál szintéziséhez ecetsavanhidrid, ketén, diaceton-alkohol, oxidok, mezitil, metil-izobutil-keton, metil-metakrilát, difenilol, izoforon és még sokan mások. Csatlakozások. Világtermelés ACETONE kb. Évente 3 millió tonna (1980).
Az ACETONE t. Vsp. -20 ° С, т. Самовоспл. 500 ° C; CPV 2,15-13,00%. Az aceton belégzéskor felhalmozódik a szervezetben. Mivel lassan válik ki a szervezetből, krónikusan lehetséges. mérgezés. MPC 200 mg / m 3.
Kémiai enciklopédia. 1. kötet >> A cikkek listájához