Halogénezett szénhidrogén-származékok alkil-, aril-, vinil-halogenidek
Halogénezett szénhidrogének: alkil-, aril-, vinil-halogenidek. A helyettesítés és a hasítás reakciója.
A haloalkánok homológ sorozata a C-X csoportba tartozó vegyületek, ahol X = F, Cl, Br vagy I. Az alábbiakban néhány csoport tagjai tartoznak:
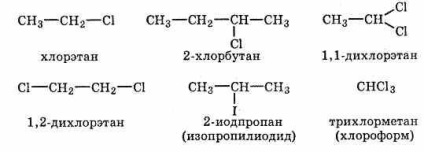
A haloalkánok három típusa létezik - primer, másodlagos és tercier:
1. Volatilitás. A fluor, a klóralkánok molekulái polárisak, mert a halogének és a szén elektronegativitása:
A C-F és C-Cl kötések erősen polárisak, ami a szomszédos molekulák dipólusai közötti vonzáshoz vezet:
2. A fluor és klór-alkánok forráspontjai közel azonosak a molekulasúlyú szénhidrogének forráspontjával. A bróm- és jódalkán molekulák enyhén polárisak. A bróm atom ugyanolyan tömegű, mint a hat-CH2 csoport, de a bróm-alkán molekula méretei sokkal kisebbek, mint az azonos tömegű alkánmolekulák. A molekulák kisebb mérete csökkenti a köztük lévő kölcsönhatást és alacsonyabb forráspontot.
A bróm- és jódalkánok forráspontja jóval kisebb, mint az azonos molekulatömegű alkánok forráspontja.
3. Oldékonyság. A halogénezett származékok vízben kevéssé oldódnak.
4. A szag. A halogénalkánok édeskés illatúak (kicsit feszesek).
5. Sűrűség. A klóralkánok könnyebbek a víznél, és a bróm- és jódalkánok nehezebbek.
Az iparban a legfontosabbak a klóralkánok, mivel a klór könnyen elérhető (NaCl-oldat elektrolízisével nyerhető). A klóralkánokat alkánokból és klórból állítják elő. Az alkánok klórozása monoklór- és poliklór-alkánok keverékéhez vezet, amelyek komponenseit desztillációval izolálhatjuk. A tiszta monokloridokat úgy állíthatjuk elő, hogy hidrogén-kloridot adunk az alkénekhez, amelyek olajfinomítással készülnek:
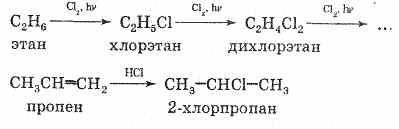
Az alkohollal és hidrogén-kloriddal klóralkánokat kaphat:
A tetraklór-metánt úgy állítják elő, hogy klórt vezetnek CS2 szén-diszulfidra egy AlCl3 katalizátor jelenlétében:
Az alkánok fluorozása nem talál gyakorlati alkalmazást. Ez túlságosan bonyolult folyamat. Azonban a polifluor-klór-
(freonok) széles körben alkalmazzák hűtőközegként. A leggyakoribb freon:
1) zsírok és olajok oldószerként;
2) hűtőközegként (például diklór-metán CCI2H2);
3) tüzek oltásakor (pl. CBr2 ClF - dibrómfluor - klór - metán).
^ A haloalkánok kémiai tulajdonságai
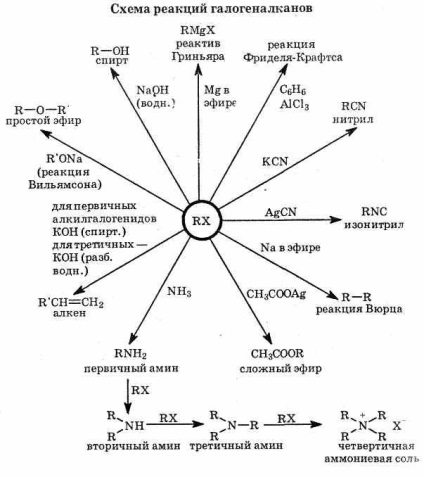
1. A halogénalkánok könnyen bejuthatnak a szubsztitúciós reakciókba. Ez annak a ténynek köszönhető, hogy a C-G kötés poláris, és van egy részleges pozitív töltés a szénatomon (). Ezért a nukleotidok, például OH- és CN-anionok könnyen támadják a szénatomot. vagy az osztatlan elektron párral rendelkező vegyületek: NH3 és H2O A halidiont "jó távozó csoportnak" nevezik, így a helyettesítési reakciók meglehetősen egyszerűek:
Ilyen reakciók például a haloalkánok alkoholokká és aminokká történő átalakítása:
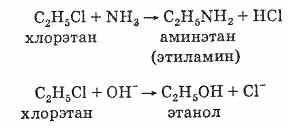
Az ilyen reakciók folytatásához szükséges feltételek nagymértékben függnek a haloalkán szerkezetétől és a nukleofil természetétől. Bizonyos esetekben a reagensek egyszerű összekeverése elegendő, másokban hosszabb melegítést igényel.
A halogénatom helyettesíthetősége nagymértékben függ a halogén természetétől. A RT kötési energiája nő a C-I sorozatban<С—Br<С—Сl<С—F. В этом же ряду уменьшается реакционная способность галогеналканов. Связь С—F настолько прочна, что фторалканы практически не вступают в реакции нуклеофильного замещения. Активность остальных галогеналканов по отношению к нуклеофилам падает в ряду RI>RBr> RCI.
2. A halogénalkánok könnyen belépnek a hasítási reakciókba. Ebben az esetben keletkeznek hidrogén-halogenidek és alkének. Ezek a reakciók a bázis hatását a halogén-alkánon folytatják. Így a haloalkánokon lévő erős bázisok hatására az NG molekulák hasadódnak és alkének képződnek:
A helyettesítési és hasítási arányok függenek a szénhidrogén-szerkezet szerkezetétől is. A szubsztitúciós reakció szerepe a következő haloalkánok sorozatában növekszik:
elsődleges <Вторичные <Третичные
A tercier-haloalkánok különösen könnyen (erős bázis hiányában) szubsztitúciós reakcióba lépnek:
Általában, a vizes bázis jelenlétében, hogy a transz-közötti primer halogén-alkánok jellemezve elsősorban hasítási reakciót, szekunder halogénezett alkánok, így rendszerint olyan elegy pro-kek hasítás és a csere, és a tercier forma elsősorban helyettesítő termékek.
A haloalkánok különböző nukleofilekkel, például CN-cianid-anionnal SN-reakcióba lépnek. acetát anion
CH3COO -. ammónia: NH3. aminok RN. H2 és még sok más.
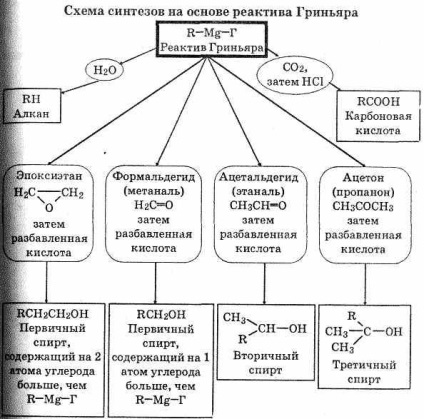
3. oldat hozzáadásával dietil-éteres haloalkánokban CH3 CH2 OCH2 CH3 magnéziumforgácsot történik ekzoter-dasági reakció: magnézium oldatba megy, és újra kialakított aktív reagenssel általános képletű R-Mg-F, amelyben R - alkil- vagy arilcsoport, és G - halogénatom.
RG Mg ^ éter R-Mg-G
A Grignard reagensek sokféle vegyülettel reagálnak, ami lehetővé teszi számukra, hogy sokféle anyag szintézisében alkalmazzák őket.
^ 4.2. Halogén-alkének (vinil-halogenidek)
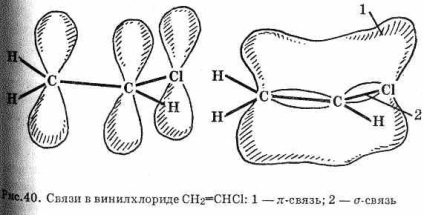
A halogén-halogenidek reakcióképessége nagyon kicsi. A halogén-alkének, amelyekben a halogénatom a sp2-hibridizált szénatomhoz kapcsolódik, nagyon közömbösek. Nem hidrolizálnak lúgokkal, és nem reagálnak más nukleofilekkel. Ezt a kettős kötésben és a halogénben lévő szénatomok p-orbitálisjainak részleges átfedése magyarázza (lásd a 40. ábrát). Ennek eredményeképpen a C-G kötések sokkal erősebbek, mint a haloalkánok, ahol csak -elektronok képződnek.
A halogén-halogenidek polimerizálása számos fontos anyagot, például PVC-t (polivinil-kloridot) eredményez.
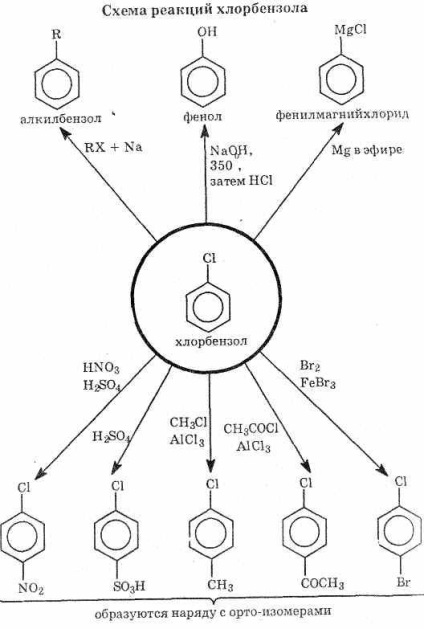
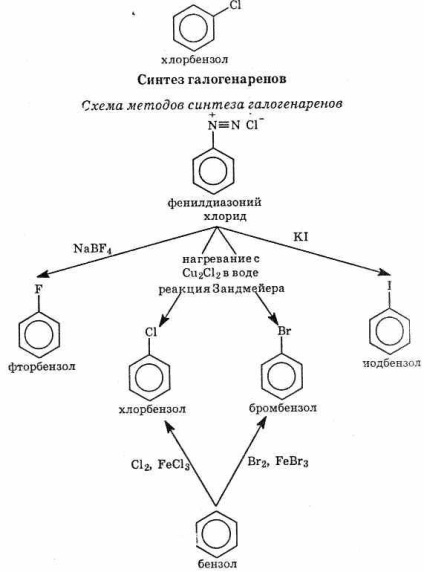
Azokat a vegyületeket, amelyekben a halogénatomok a benzolgyűrű szénatomjaihoz kapcsolódnak, haloaréneknek nevezik.
A haloarének kémiai tulajdonságai
A halogénarének sokkal kevésbé reaktívak, mint a halogénalkánok. E tekintetben a haloarének hasonlóak a halogén-alkénhez. A C-G kötése a halogén-arénokban sokkal erősebb,
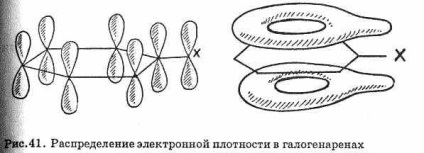
halogén-alkánok, mint átfedés miatt a p-pályák a halogénatom a -pályák a benzolgyűrű (ábra. 41), hogy a redukálható-dit, hogy növelje a szén-halogén kötés erőssége, és akadályozza halogén szubsztitúciós reakció.
A haloarének kétféle reakciója ismeretes: a halogén szubsztitúciója és a benzolgyűrűben történő szubsztitúció (lásd a diagramot).
Halogénatom helyettesítése
1. A haloarének hidrolízise csak nehéz körülmények között fordul elő. Egy példa a fenol C6H5OH klór-benzolból történő szintéziséről. Az iparban a fenolt úgy állítják elő, hogy a klór-benzolt nátrium-hidroxiddal 150 ° C-on 350 ° C-ra melegítik. A kapott nátrium-fenolát hígított sav hatásával fenolvá alakul át:
2. A halogén lehet szubsztituálva egy szénhidrogéncsoporttal: I C6H5Br2H5Br2Na6C6H5-C2H5N2Br
^ A benzolgyűrűn végzett helyettesítések
A Halogénarének kevésbé reaktívak, mint a benzol. A benzolgyűrűre jellemző szokásos reakciókba lépnek, beleértve a szubsztitúciós reakciót is. A halogénatom elektronokat von be a benzolgyűrűből, deaktiválja, de egy orto-, para-orientáló (lásd a 3.3.
A táblázatban. 37 összehasonlítjuk a haloalkánok és a halogéngarnének tulajdonságait.