Iniciálás, növekedés és lánclezáródás kationos polimerizációban
A kationos polimerizáció iniciátorja pozitív töltésű részecskék forrása, amely spontán módon vagy egy monomerrel vagy egy specifikusan adagolt vegyülettel történő reakcióval jön létre. Tipikusan az iniciátorok savas anyagok: proton és aprotikus savak, Lewis sav komplexek elektron donor vegyületekkel, Ph3 C + · SbCl6 típusú karbonátok. Az Et3O + · SbCl6 típusú oxónium sói
A Lewis-savak az AlCl3. BF3. SnCl4. ZnCl2. TiCl4, stb. - az alkének alacsony hőmérsékletű kationos polimerizációjára használják, ami nagy molekulájú polimerek képződéséhez vezet. Ezeket a savakat általában protonadományozóval vagy egyéb adalékokkal kombinálva alkalmazzák.
1. táblázat: Az alkének polimerizációjának egyes kationos iniciátorai
A kationos polimerizáció megkezdéséhez a protikus savakat csak akkor használjuk, ha az általuk képzett anionot nem erõs nukleofilitás jellemzi; egyébként kovalens kötést képez a protonált monomerrel:
A halogének nagy nukleofilitásának köszönhetően a hidrogén-halogenidek nem használhatók kationos polimerizációs iniciátorokként. Bizonyos monomerek (például telítetlen szénhidrogének, kumaron, indén) polimerizációjához foszforsav, kénsav és klórsav alkalmazható, bár rendszerint oligomereket kapnak.
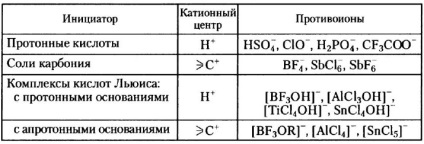
Így az izobutilén nem érzékeny a száraz BF3-ra. de azonnal polimerizálódik, amikor nyomnyi mennyiségű vizet ad hozzá; az aktivátor (víz) reagál az iniciátorral, és komplexet képez, amely protonálja a monomert és kationos részecskéket képez, amelyek további láncolást indítanak:
A kezdeti szakaszban a proton a monomer molekulához és egy ionpárhoz kapcsolódik
Ez az ionpár ezután reagál a következő monomer molekulával:
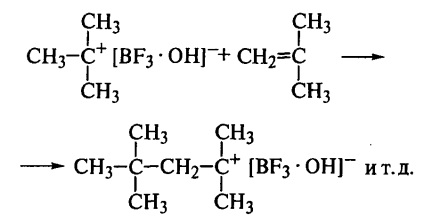
Így a növekvő lánc végén mindig van egy karbocation egy anti-anionnal. A monomer molekula polarizációjának köszönhetően a "fej-farkon" összeköttetések rendszeres rögzítése biztosított, mivel egy másik típusú csatolás egyszerűen nem lehetséges itt. Ezért a polimerlánc kémiailag rendszeres szerkezetű. A táptalaj (klórozott szénhidrogének) alacsony dielektromos permittivitása hozzájárul az ionpár megőrzéséhez a lánc növekedés során.
Általánosságban elmondható, hogy a kationos polimerizáció Lewis-savak és aktiváló adalékok jelenlétében történő iniciálásának folyamata a következő sémákkal reprezentálható:
Ami az aktivátorokat, például alkil-halogenideket, például a rendszerben van:
akkor a kezdeményező kationos fajok kialakulása csak a monomer részvételével lehetséges:
Alapvetően csak Lewis-sav katalizálható, ha képes ionpár kialakítására:
A fentebb említett kationos polimerizációs iniciátorokon kívül I2 is használható. Cu 2+. valamint a nagy energiájú sugárzást. A jód katalitikus hatása a következő átalakulásokon alapul:
Így a HI aktivátorként működik az I2 vonatkozásában. A Cu 2+ ion a polimerizációt vagy a π-kötés oxidációjával (az elektron elektron átalakítása a monomerről Cu 2+ -re) vagy π-kötéssel indítja el.
A karbóniumsók esetében lehetséges egy iniciációs mechanizmus, amely abból áll, hogy egy elektronot a monomertől a kationig átvittek, amely szabad gyököt és egy monomer gyökös kationát képez:
Az e rendszer szerint képződött szabad gyökök rendkívül stabilak és nem tekintendők kiindulási anyagként.
A kationos polimerizációban a lánc megszüntetése sokkal fontosabb, mint az anionos folyamatban. Anionos polimerizáció esetén lehetőség nyílik a láncok zökkenőmentes növekedésére és az "élő" makromolekulák állandó koncentrációjának hosszú távú megőrzésére; ez sokszor lehetővé teszi a folyamat "újjáélesztését" úgy, hogy további mennyiségű monomert vezet be, és ezzel növeli a láncok hosszát.
A kationos polimerizációban az aktív helyek élettartama általában alacsony. Abban az esetben, kationos polimerizáció, például a sztirol és izoprén, ez a fő oka a kialakulásának termékek polimerizációs fokú meg nem haladó 50. A közös tulajdon -MnM + típusú aktív helyek a tendencia stabilizáció proton eltávolításával elfog bármilyen anion vagy izomerizációs hogy stabilabb állam. Ezért a nagy molekulájú polimer kialakulása a kationos iniciáció során a növekedési folyamatok aránya és az aktív helyek stabilizálása alapján határozható meg. Tekintsük a lánctermináció és a kationos polimerizációban történő átvitel reakciói rendszerét:

Így az izobutilén H + [BF3OH] jelenlétében történő polimerizálásakor ezek a lánctermináció és átvitel (kivéve (1.b) kivételével) a következőképpen járnak el:
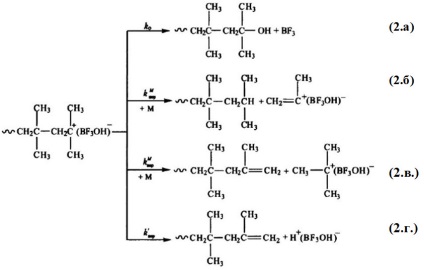
A (2.b) és (2.b) reakciók kinetikailag megkülönböztethetetlenek, de az első a lánc telített végső fragmensének képződéséhez vezet, míg a második telítetlen lánchoz, valamint a reakcióhoz (2.d) vezet. A három megfigyelt reakció hasonló ahhoz, hogy a kinetikus lánc nem szünetel lefolyásuk eredményeképpen, és az iniciátor-aktivátor komplex (iniciátor-monomer-aktivátor) minden részecske képes új lánc növekedésének megkezdésére.
Egy kovalens kötés kialakulása egy elleniontal való kölcsönhatás során (reakció (1.b)) a sztirén trifiuor-ecetsavval való polimerizációjában lévő láncvégződés:
A monomerre kifejtett láncátvivő reakció nem befolyásolja a polimerizációs sebességet, de segít a polimer makromolekula hosszának szabályozásában, azaz E. egy keskeny molekulatömeg-eloszlású polimer.
A láncnak a monomerre történő átvitelén kívül az oldószerre, szennyeződésekre vagy speciálisan bevezetett anyagokra történő átjutás is lehetséges:
A CA transzmitterek lehetnek víz, alkoholok, savak, anhidridek, éterek és észterek, aminok és más vegyületek.
Sok láncadót (víz, alkoholok) gyakran használnak aktivátorokként, ezért az iniciátorhoz képest egyenértékű mennyiséget meghaladó mennyiségben történő felhasználás a láncátviteli folyamatok részesedésének növekedéséhez és a molekulatömeg csökkenéséhez vezethet.
Az egyes szakaszok sebességét a következő formában lehet írni:
A karbónium ion képződése
Az I ionizációs potenciál (ionizációs energia) olyan energia, amelyet az elektron molekulából vagy atomból a gázfázisban való eltávolításához szükséges:
Az alkilcsoportok ionizációs potenciálját a 2. táblázatban adjuk meg.
2. táblázat Az alkilcsoportok ionizációs potenciálja
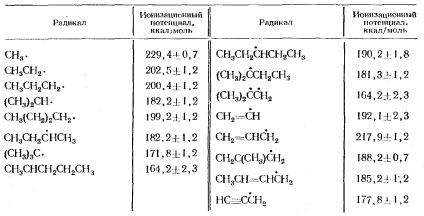
A metil- és etilgyökök ionizációjának összehasonlítása a 3. ábrán látható. 2.
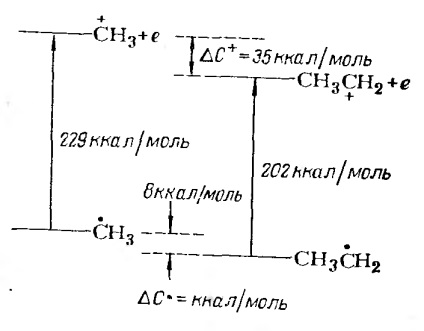
2. ábra. A metil- és etilgyökök ionizációs potenciáljának összehasonlítása. A karbónium ion stabilizálásának energiája # 916; C + és radikális # 916;
Stabilizációs karbóniumion metilcsoport 147 kJ / mol (35 kcal / mol), miközben, mint a stabilizációs a gyök metilcsoport 33,6 kJ / mól (8 kcal / mol).
Proton affinitás
Fontos, hogy az egyes olefinek bázikusságát a proton és a szénion affinitása szempontjából az alábbi egyenlettel összhangban értékeljük:
Az olefinek protonhoz való affinitását a következő négy szakasz határozza meg:
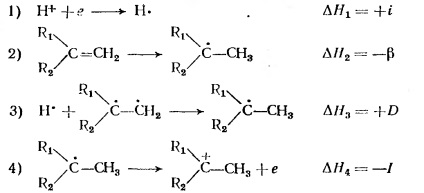
Itt i, a proton elektronhoz való affinitása a hidrogénatom ionizációs potenciáljának reciprokságaként definiálódik; # 946; - a kettős kötés kibocsátásának energiája; D a C-H kötés energiája; I a hidrogénatomnak az olefinekhez való hozzáadásával kialakított radikális ionizációs potenciálja.
Minden aszimmetrikus olefin esetében a proton affinitása attól függ, hogy melyik szénatomhoz kapcsolódik. Az etilénre, propilénre és izobutilénre vonatkozó adatokat a 3. táblázatban adjuk meg.
3. táblázat: Proton és atom affinitása (kcal / mol) olefinekhez
A karbónium ionhoz (Cl és C2, pl. P1 és P2) való affinitása változik, valamint a proton P1 (és C1) affinitása, és jelentősen növekszik az etilén és az izobutilén között. Ez magyarázza azt a tényt, hogy a reaktivitás az etiléntől, amely nem aktív a kationos katalizátoroknál, nagy aktivitással rendelkező izobutilénre nő. Amint az a 3. táblázatban látható, a gyök ionizációs potenciáljának csökkenése növeli a proton affinitását.
A 3. ábra azt mutatja, hogy a gyök és monomer ionizációs potenciálja lineáris kapcsolatban van.
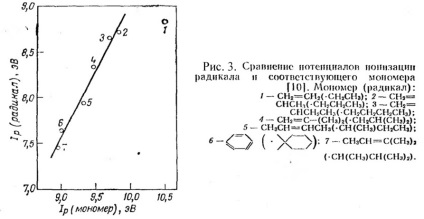
2.2.4. A szabad energia változása a karbónium ion képződésében
Az ion stabilitását a szabad energia alakulásához kell kapcsolni.
4. táblázat: Az ionizáció entalpiája a gázfázisban
R - Br → R + + Br - (a heterolitikus kötés disszociációjának energiái)
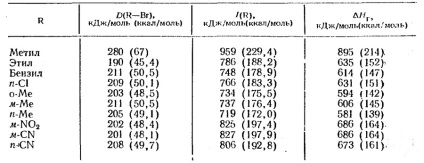
Azonban az alkil-halogenidekből származó karbóniumionok gázfázisban való képződéséhez csak az entalpia értékeket ismerjük, amelyeket az elektron ütésmérési adatokból határozunk meg, és ezáltal a heterolitikus disszociációs energia származéka. Mivel az entrópia megfelelő változásai kicsiek, elvileg lehetőség van arra, hogy az entalpia változása révén becsüljük meg a szabad energia változását (4. táblázat)
Az Rx alkilhalogenid R + és X-ionokra történő elválasztásához szükséges energia. az energiaváltozás összegeként három hipotetikus szakaszban ábrázolható:
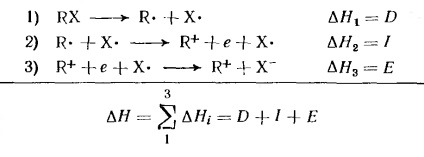
érték # 916; H1 a kötés homolitikus disszociációjának energiája; # 916; H2 az alkilcsoport ionizációs potenciálja; # 916; H3-affinitás az X atom elektronjához (az alkil jellegétől függetlenül). Az alkilcsoportok ionizációs potenciálja és # 916; H-halogenidek képződését karbóniumionok táblázatban adjuk 4. Ezek az adatok teljesen szétválasztott ionok a gázfázisban. Amint látható a 4. táblázatból, a disszociációs energiája alkil-vegyületek és a ionizációs potenciál hirtelen jellegétől függ R. gázalakú ionok által karbónium heterolízis semleges molekulák ez energiaigényes, és ezért csak ritkán figyelhető meg kísérletileg.
A szerves reakciók, köztük a karbóniumion oldat kialakulása sokkal gyakoribbak.
A karbóniumion reakciói az oldatban szükségszerűen tartalmaznak ionszolvatációt. Az oldószerrel való kölcsönhatás stabilizálja a karbóniumiont és az elleniont. Mivel a stabilizáció elsősorban az elektromos töltések jelenlétével függ össze, az ionizált formák jobban szolvatálódnak, mint a nem ionizáltak. Minden oldószer valamilyen szolvatációt eredményez (a gázfázishoz viszonyítva).
Az RX szerves molekula ionizációjának tervezése a gázfázisban és az oldatban a 4. ábrán látható. Ezen a ponton az R + és X ionizációjának átmeneti állapota elválasztott ionok.
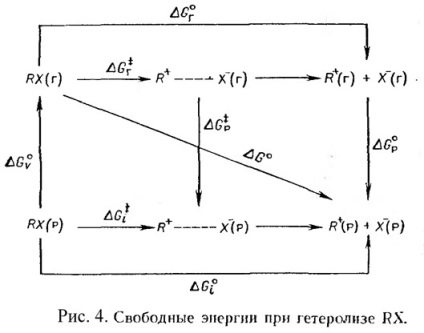
Ez eléggé nyilvánvaló # 916, G 0 az ionképződés szabad energiájában a gázhalmazállapotú alkil-halogenid standard változása - összegét úgy kell kifejezni, # 916; G 0 p + # 916, G 0 g, a 4. ábrából következik:
Az ionszolválás szabad energiáját általában egy empirikus egyenletből számítják ki, amelyet gyakran Born-egyenletnek neveznek. A szabad energia változása, ha az ion egy sugarú sugárral és a gázfázistól az oldószerig (D) átmozgat:
A (11) egyenlet szerint az ion szolvatációs energiája nagyobb lesz a nagy dielektromos permittivitású oldószerekben.
Szintén fontos a specifikus szolvatáció és polarizálhatóság. Nyilvánvaló, hogy egy kis sugár ionjait jobban szolvatálták, és ez valóban igaz a szervetlen kationokhoz. Ebből következik, hogy az ion és az oldószer közötti legerősebb kölcsönhatás az ion kis kicsi sugara és a táptalaj dielektromos állandójának nagy értéke között fordul elő.