Oktatás-módszeres kézi "anyagvédelem korrózió ellen", 4. oldal
Anódos szabályozás esetén a korrózió sebessége a fémionok koncentrációjának növekedésével csökken a felület közelében. Ez olyan mérsékelten oldódó sók képződéséhez vezethet, amelyek a fém felületének szűrésével diffúziós nehézségeket okoznak az anódos reakció során.
Az anódos reakció gátlása a fém passziválásának eredményeképpen lehetséges, ha erős oxidálószerrel érintkezik. A fém passzív állapotát a jelek jellemzik:
· A fémpotenciál pozitív irányú elmozdulása;
· A korrózió sebessége jelentősen csökken és időben állandó.
A passzív állapot kialakulása függ a fém jellegétől, tulajdonságaitól, a korrozív közeg típusától (oxidálószer koncentráció, oldott oxigéntartalom), a hőmérséklettől és az elektrolit keverés sebességétől. A passzív állapot megsértését túlcsordulásnak nevezik.
Küzdelem superpassivation lehetséges eltolásával a lehetséges a fém a negatív irányban, csökkenő oxidálószer koncentrációja, redukálószert adunk, vagy a katódos polarizáció a fém külső áramforrás.
Különböző tényezők hatása az elektrokémiai korrózió sebességére.
A hőmérséklet befolyásolása.
A hőmérsékletnövelés megkönnyíti az elektródákban résztvevő anyagok diffúzióját. A hőmérséklet befolyásolja az elektrodi folyamatokban részt vevő anyagok korrozív közegben való koncentrációját. Az oxigén depolarizációval járó semleges közegben levő korrózió az oldott oxigén elszívása miatt növekvő hőmérsékleten csökken. A hőmérséklet-változás csökkentheti a barrier filmek tulajdonságainak a másodlagos termékek (oxidok, hidroxidok, nehezen oldódó sók), valamint a változás polaritás típusú fém-bevonatok: cink bevonat szénacél viselkedik az anód, és a forró vízben - katódként. A hőmérséklet növekedése a korróziós folyamat fokozásához és lelassulásához vezethet.
A tápközeg pH-jának hatása.
A környezet pH-értékének hatására a fémeket csoportokra osztják:
1. Magas korrózióállóságú fémek savas, lúgos és semleges oldatokban (pl. Au, Pt, Ag). Korróziós sebességük nem függ a közeg pH-értékétől (1a. Ábra).
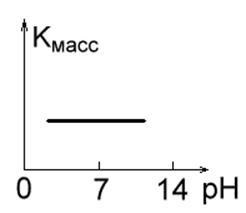
Ábra. 1a. Ábra. 1 b.
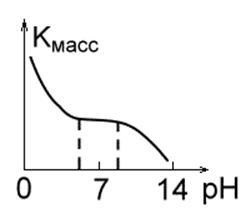
2. Olyan fémek, amelyek savas közegben alacsony stabilitásúak, mint a Fe, Mg, Cu, Mn. Alacsony pH-érték mellett a megsemmisítésük aránya magas, a hidrogén könnyen felszabadul és oldható korróziós termékek képződnek. A 4,0-8,5 pH-tartományban ezeknek a fémeknek a korróziós sebessége állandó. PH értéknél ≥ 10 oldhatatlan hidroxid képződik, és a korrózió sebessége élesen csökken (1b.
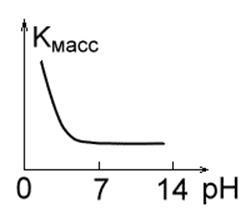
Ábra. 1 in. Ábra. 1 г.Рис. 1 nap
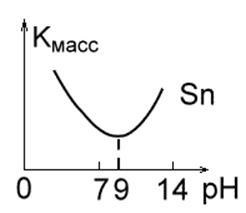
3. Fémek, amelyek semleges közegben stabilak, de lúgos és savas oldatban megsemmisülnek amfoteritásuk miatt (1c. Ábra). Ez Zn, Al, Sn, Pb. Az oldat bizonyos pH-értékével jellemezhető, ahol a korróziós ráta minimális: Al-7,0; Pb-8,0; Sn-9,0; Zn = 10,0; Fe - 14,0.
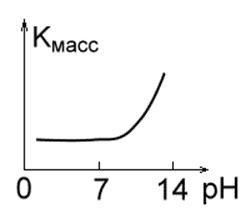
4. Fémek, amelyek savas, de instabil lúgos közegben stabilak, Mo, Ta, W (1. ábra).
5. Fémek, amelyek savas közegben alacsony ellenállásúak, de lúgosak: Ni, Cd. (1 e ábra).
A nyomás hatása az elektrokémiai korrózió sebességére
A nyomás hatása összetett. Az oxigén diffúziós sebességének növekedése miatt a korrózió először megnő, majd a korrózió sebessége csökken, mivel a fém felületén védőfilm keletkezik. A korrózió sebessége meredeken emelkedik, mivel a védőfólia mechanikus eltávolítása az elektrolit mozgó áramlásával történik. Az elektrolit mozgási sebessége erőteljesebben befolyásolja a korróziót oxigén depolarizációval, mint hidrogénnel.
Az elektrolit összetételének hatása.
Ahogy a megoldás koncentrációja nő, a korróziós sebesség először megnő, majd csökken. A korrózió növekedését az oldat elektromos vezetőképességének növekedése (az anódos reakció erősítése) magyarázza, és a korrózió csökkenése az oxigén oldhatóságának csökkenésével jár.