Valódi gázállapot egyenletei
A valódi gáz viselkedése a legegyszerűbb és minőségi szempontból helyes. a van der Waals egyenlet:
(P + a / n2) · (n-b) = R · T. (6.3)
a, b állandók, az előbbi figyelembe veszi az interakciós erőket, a második a molekulák méretét veszi figyelembe.
a / n 2 - a további nyomást jellemzi. amely alatt az igazi gáz a molekulák közötti kohéziós erőknek köszönhető, és amelyet belső nyomásnak neveznek. A folyadék testek esetében ez a nyomás nagy értékekkel rendelkezik (például 20 ° C-os víz esetében 1050 MPa), és a gázok esetében a molekulák alacsony kötőereje miatt nagyon kicsi. Ezért a külső nyomás. amely alatt folyadék van. jelentéktelen hatást gyakorol a térfogatára, és a folyadék összenyomhatatlan. A gázok esetében az a / n 2 értékének kicsi értéke miatt a külső nyomás könnyen megváltoztathatja a térfogatukat.
A van der Waals egyenlet minőségi szempontból helyesen tükrözi a folyékony és gáznemű anyagok viselkedését. kétfázisú állapot esetén nem alkalmazható.
A PV diagram (6.1 ábra) a van der Waals egyenletből kialakított izotermeket mutatja. A görbékből látható, hogy viszonylag alacsony hőmérsékleten hullámzó régiók vannak. Minél magasabb a hőmérséklet. annál rövidebbek azok a görbék. Ezek a hullámzó görbék folyadékállapotról egy adott hőmérsékleten lévő gőzre történő folyamatos átjutást jeleznek. Az A pont megfelel a folyadék állapotának. a B pont az anyag gőzállapotára utal.
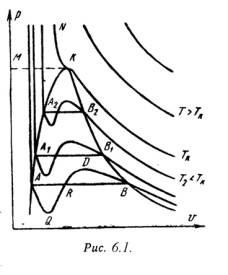
A valóságban a folyadéktól a gőzállapotig való átmenet mindig kétfázisú anyagállapoton keresztül történik. Ezen a hőmérsékleten az átmenet folyamat állandó nyomáson is megtörténik. Ez a tényleges átmenet a folyékony állapotról a gőzre az AB egyenes.
Gyakorlatilag különösen tiszta anyagok esetében lehetséges az AQ és a DB hullámszerű görbéi. Az első esetben a túlhevített folyadék instabil állapota megtörténik. és a második - túlhűtéses gőzben.
Bizonyos hőmérsékleten a Van der Waals-egyenlet izotermája nem lesz hullámszerű szakasz (K pont). Ezt a hőmérsékletet kritikusnak nevezik. Ha az A1 pontokat csatlakoztatjuk. A2. A3 ... és B1. B2. B3. egy parabolahoz hasonló görbét kapunk. Az AK görbét az alsó határgörbének nevezik, és megfelel a folyadék forráspontjának. A KV görbét a felső határgörbének nevezik, és megfelel a száraz telített gőz állapotának.
Így egy valódi PV-anyag számára - a diagram három részre osztható:
1 - a folyadék állapotának területe az alsó határgörbe bal oldalán helyezkedik el;
2 - kétfázisú állapotok (nedves pára) régiója, az alsó és felső határgörbe között);
3 - a túlhevített gőz területe. a felső határgörbe jobb oldalán és a kritikus pont fölött helyezkedik el. Feltételesen a folyékony területet a KM vonal - a kritikus izobár - tetején határolja.
A kritikus paraméterek és a van der Waals egyenlet állandói közötti kapcsolat:
A nagy gáztömegű van der Waals egyenlet jelentős hibákat eredményez. Ezenkívül kísérletileg bizonyították, hogy az a, b együtthatók a hőmérséklet és a nyomás függvényei. és ez a függőség nagyon bonyolult.
Az MPVukalovich és a II Novikov 1939-ben új univerzális egyenletet javasolt a valódi gázok állapotához, figyelembe véve molekuláinak társulását és disszociációját. amely a következő formában van:
(6 + 2m) / (2) / (n +
C, m - konstansok, amelyeket kísérleti adatok alapján határoznak meg.