Párhuzamosan reagáló kiindulási anyagok keverékei, feladatok 1
1. feladat.
34 g kálium-hidroxid és nátrium-hidroxid keverékét tartalmazó oldatot semlegesítjük felesleges sósavval. Ennek eredményeként 47,9 g sót képzünk. Határozza meg az egyes hidroxidok tömegét a takarmánykeverékben.
adott:
a hidroxidok keverékének tömege a kiindulási p-re: m (KOH + NaOH) = 34 g;
a sók tömege az oldat semlegesítése után: só elegye = 47,9 g.
Keresés:
kálium-hidroxid tömege a kiindulási keverékben: m (KOH) =
a nátrium-hidroxid tömege a kiindulási elegyben: m (NaOH) =
megoldás:
A keverék mindkét összetevője (KOH és NaOH) egyszerre kölcsönhatásba lép a sósavval. A keverék minden egyes anyagára a kémiai reakciókat rögzítjük:
KOH + HC1 = KC1 + H20
NaOH + HC1 = NaCI + H20
A probléma megoldása számláló algoritmus alkalmazásával történik. Ez a következőképpen ábrázolható:
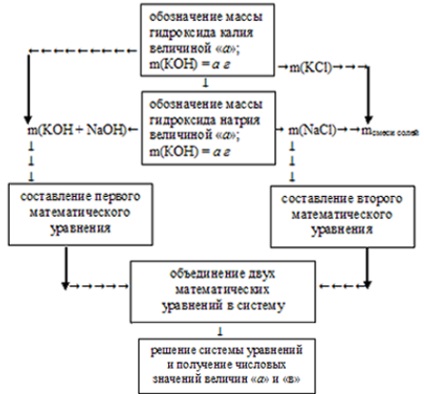
Ebben az állapotban meg kell határozni az egyes hidroxidok tömegét, így a KOH tömegét az "a" mennyiség és a NaOH tömegének "in" értékével fogjuk jelölni.
1. A megadott értékek segítségével összeállítjuk az első matematikai egyenletet. Ehhez a hidroxid-tömegek összegét a kezdeti oldat teljes tömegére számoljuk:
a + b = m (KOH + NaOH) = 34 g,
a + b = 34.
Egy ismeretlen matematikai egyenletet kaptunk.
2. Az ismert "a" és "b" értékek alkalmazásával a semlegesítési reakciók egyenleteivel meghatározzuk a kapott sók tömegét:
Mi az arányt alkotjuk:
és r KOH esetén x, KCl (feltételezéssel)
56 g KOH alkalmazásával 74,5 g KC1-t (az egyenlet szerint)
Mi az arányt alkotjuk:
g NaOH-ban nátrium-kloridot adunk (feltételezve)
40 g NaOH-t adunk 58,5 g NaCl-t (az egyenlet szerint)
3. Ismert feltétel, hogy a kapott sók össztömege 47,9 g. Az előző lépésben kapott értékek felhasználásával a második matematikai egyenletet két ismeretlen módon állítjuk össze:
4. Két matematikai egyenletet egyesítünk a rendszerben:
Az egyenletek rendszerének megoldása a következő értékeket adja:
a = 13,4 g; c = 20,6 g.
Az "a" értéke a KOH tömegét jelöli, ezért:
az "in" értéke a NaOH tömegét jelöli, ezért:
Válasz: m (KOH) = 13,4 g; m (NaOH) = 20,6 g.
2. feladat.
A gázfejlődés végéig 92 g kalcium-karbonát és vízmentes kalcium-nitrát keverékét kalcináltuk. Ennek eredményeképpen gázok keveredtek, amelyek relatív sűrűsége 26,63 hidrogén volt. Határozzuk meg az egyes keverékben lévő sók tömegét az eredeti keverékben.
adott:
sóösszetétel tömege: keverék [CaCO3] + Ca (NO3) 2] = 92 g;
a gázkeverék hidrogénben való viszonylagos sűrűsége: D (H2) = 21,63.
Keresés:
kalcium-karbonát tömege a kiindulási keverékben: m (CaCO3) =
a kalcium-nitrát tömege a kezdeti keverékben: m [Ca (NO3) 2] =?
megoldás:
Az egyes sók bomlási reakcióit lejegyezzük:
Ennek megoldásához a számláló algoritmust kell használni:
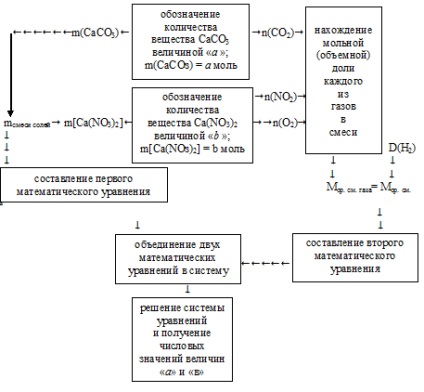
A bemutatott algoritmust alkalmazzuk.
1. A szükséges mennyiségek a sók tömegei a kezdeti keverékben. A további számítások nagyobb kényelme érdekében ésszerűbb az "a" érték használata a kalcium-karbonát: n (CaCO3) = mol. Mennyiségének (n, mol) mennyiségének a jelölésére.
A "b" mennyiség a kalcium-nitrát anyagának (n, mol) mennyiségét jelenti: n [Ca (NO3) 2] = b mol.
Ennek megfelelően ezeknek a sóknak a móltömegein keresztül maguk a sók tömegei is képesek:
2. A kiindulási sók teljes tömegét feltüntetik az állapotban. Ez lehetővé teszi számunkra, hogy az első matematikai egyenletet két ismeretlenel össze lehessen állítani:
3. Továbbá az "a" és "c" bevitt értékek alkalmazásával a bomlási reakciók egyenleteiből meghatározzuk az egyes gázok anyagmennyiségeit:
n = mol n = x mol
CaCO3 = CaO + CO2 ↑
n = 1 mól n = 1 mol
Tegyük fel az arányokat:
és egy mól CaCO3-t adunk x mól CO2-nak (az állapotnak megfelelően)
1 mól CaCO3 ad 1 mól CO2-t (az egyenlet szerint)
Tegyük az arányokat:
b mól Ca (NO3) 2 esetén x mól NO2-t (az állapotnak megfelelően)
2 mól Ca (NO3) 2 esetén 4 mól NO2-t (az egyenlet szerint)
b mól Ca (NO3) 2 esetén egy mol O2-t (az állapot szerint)
2 mól Ca (NO3) 2 esetén 1 mól O2-t (az egyenlet szerint)
4. Határozza meg a keverékben lévő összes gáz mólfrakcióját (egy frakcióban).
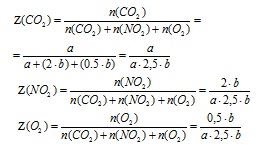
5. Határozzuk meg a gázkeverék átlagos móltömegét a keverékben lévő mólfrakcióik értékeiből.
Az Avagadro-törvény szerint a keverékben lévő gáz moláris frakciója számszerűen egyenlő a térfogati frakcióval (csak a gázok esetében), így az Mn meghatározására szolgáló képletben. helyettesítjük a térfogati frakciót (Z)
a megfelelő gáz moláris frakciójának () értéke.
6. Határozza meg a gázkeverék átlagos móltömegét a relatív sűrűség adatokból.
7. Az Msp. a két korábbi műveletben kapott gázkeverékekből a második matematikai egyenletet alkotjuk:
8. Egyesítjük a rendszer második és hetedik akciójában kapott egyenleteket
Ha megoldódik, az értékek: a = 0,1; b = 0,5.
Az "a" és a "b" mennyiségek a CaCO3 és a Ca (NO3) 2 anyag mennyiségét jelzik a sók kezdeti keverékében, így:
9. Határozza meg a sók tömegét a kezdeti keverékben:
- Ön itt van:
- legfontosabb
- feladatok
- EGE-kémia
- A keverékek szelektív szétválasztása 1. feladat