15 aminosavak
1.3. Kémiai tulajdonságok
1.4. Optikai izomerizmus
2.2. Peptid kötés
Meghatározás: A molekulában a karboxilcsoportot és aminocsoportokat tartalmazó szerves vegyületeket aminosavaknak nevezik. Az aminosavmaradékokból fehérjék épülnek fel - a fő anyag, amelyből az élő természet tárgyai állnak. Ezért az aminosavak nagyon fontosak.
1.1. Osztályozás, nómenklatúra, izomerizmus.
26 a-aminosav, amelyekből a fehérjék épülnek, saját nevük van. Például: glicin, alanin, valin, szerin stb. Rational nómenklatúra alapul triviális nevek a karbonsav kerül az előtag „aminocsoport” és betűvel jelöljük a görög ábécé hidroxi-helyzetben. A szisztematikus nómenklatúra szerint a lokán az aminocsoport helyzetét jelöli. A karboxilcsoport mindig az első pozíciót foglalja el. Cím felépítve szénhidrogén kiegészített az előtag „aminocsoport” és az utótag „OIC” vagy „diovaya”.
A monobázisos aminosavak homológ sorozatát egy aminogoikus vagy hiányos szénsav amiddal kezdjük. Ezután jön a glicin vagy az aminoacetát. Ezek a két savak nem rendelkeznek szerkezeti izomerekkel. Az aminosavak izomerizmusa összefügg az aminocsoport helyzetével és a szénváz szerkezetével. Ezért az alábbi karbonsavakat - propionsav - molgut két izomer eltérő abban a helyzetben, az amino-csoport: α-amino-propionsav és propionsav β- Mino. Négy szénatomot tartalmazó sav létezhet öt izomer formájában. Három az n-vajsav és a két izovajsav.
Minden természetes aminosav, kivéve az aminoacetátot, aszimmetrikus szénatomot tartalmaz. Mindegyik az L-sorozat tagja.
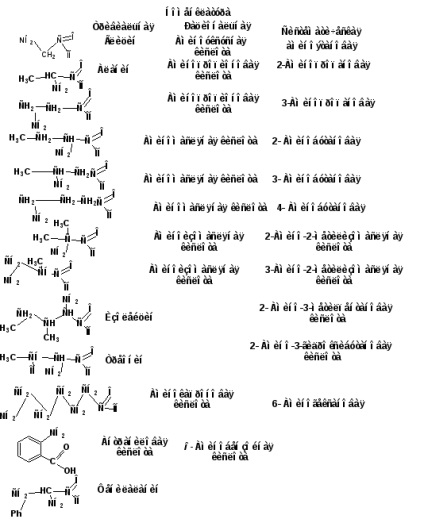
1.2. A megszerzés módszerei
Az ammónia hatása az a-halogén-karbonsavakra:
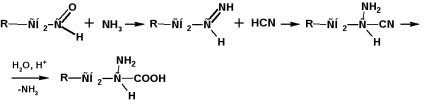
Előkészítés a Strecker-Zelinsky módszerrel
Ezzel az eljárással az aldehidet kálium-cianid és ammónium-klorid keverékének vizes oldatával kezeljük:
Az ammónia hozzáadása az α, β-telítetlen savakhoz:
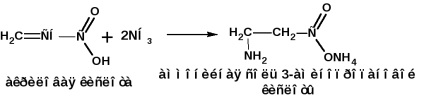
Fogadás Rodionov módszerrel:
Módszerek más aminosavak előállítására
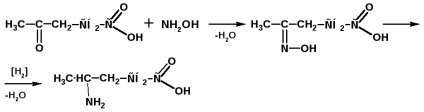
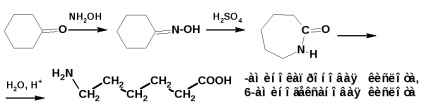
Γ-aminosav előállítása levulinsavból:
A Beckmann-átrendeződéssel több funkciós csoporttal rendelkező aminosavakat kapunk. Például kaprolaktám és ω-aminosav (ω-kapronsav) előállítása:
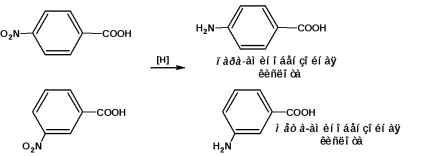
para- és meta-amino-biszzo-savat állítunk elő a megfelelő nitro-benzoesavak redukálásával:
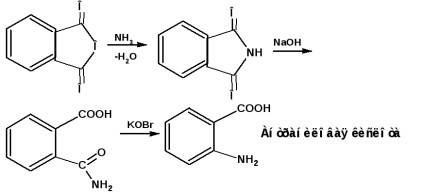
orto-izomer. az úgynevezett antranilinsavat ftálsav-anhidridből, ftalimidből hipobróm hatására állítjuk elő:
1.3. Kémiai tulajdonságok
Az aminosavak olyan színtelen kristályos anyagok, amelyeknek magas olvadáspontjai vannak, és amelyek nem különböznek a különböző aminosavaktól, ezért nem jellemzőek. Az olvadáshoz az anyag bomlása kapcsolódik. A sókra jellemző bomlással történő olvadás. Mivel az aminosavas sók könnyen oldhatók vízben. Az aminosavak vizes oldata semleges reakcióval rendelkezik, amely a sókra is jellemző. Az aminosavak az úgynevezett belső sók (bipoláris ionok):
Ilyen ion savas közegben úgy viselkedik, mint kation, mivel disszociációja a karboxilcsoportok elnyomott, és egy aminosav lúgos közegben viselkedik, mint egy anion:
A pH érték, amelynél a bipoláris ion maximális koncentrációját elérjük, az izoelektromos pontnak nevezzük.
Más vegyes funkciójú vegyületekhez hasonlóan az aminosavak a savak és az aminok tulajdonságait mutatják.
Az aminosavak sókat képeznek bázisokkal. A nehézfémekkel rendelkező a-aminosavak sói komplex jellegűek lehetnek:
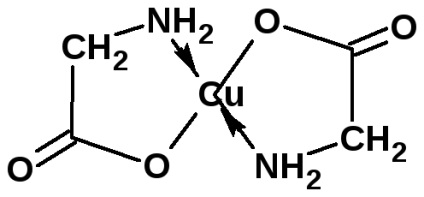
a só intenzíve kék színű.
Az aminosavak szervetlen savakkal képzett sókat képeznek:
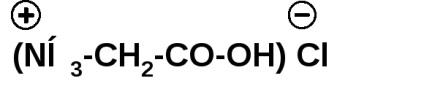
A többi savhoz hasonlóan az aminosavak észtereket, savkloridokat, amidokat stb.
A salétromsav hatása alatt az aminosavak hidroxi-savakat alkotnak:
Az aminosavakban lévő aminocsoport könnyen acilezhető anhidridek és savkloridok hatásával:
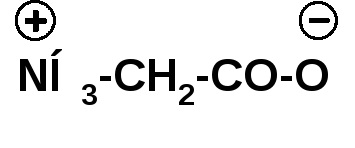
Az aminocsoport alkilezése során a szekunder és tercier aminosavakat kapjuk. A halogén-alkil-csoport fölött négy szubsztituált ammónium-bázis képződik. Az ilyen bázisok belső sóit betainoknak nevezik:
Az α, β és γ-aminosavak viselkedése melegítéskor:
a-aminosavak intermolekulárisan ciklikus amidokat - diketopiperazinokat állítanak elő:
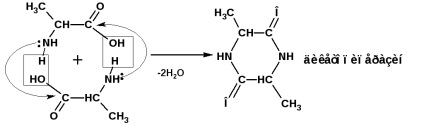
β-aminosavak, ha melegítik, az ammónia molekulát hasítják, hogy α, β-telítetlen savakat (ammóniumsó) képezzenek:
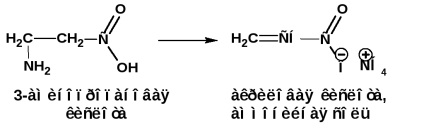
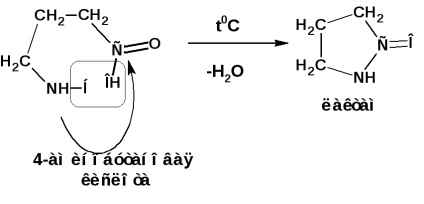
γ és δ-aminosavak, melegítéskor, vízleválasztás és intramolekuláris ciklusos amidok-laktámok formájában:
Definíció. A fehérjék összetett, nagy molekulatömegű szerves vegyületek. Ezek amidkötésekkel kapcsolt aminosavmaradékokból állnak.
A fehérjéket fehérjékre (egyszerű fehérjékre) osztják fel, amelyek csak aminosav-maradékokat és fehérjéket tartalmaznak (komplex fehérjék). Ezek a fehérjék nemcsak aminosavakból, hanem más anyagokból is származnak: szacharidok vagy foszforsavmaradékok és nukleinsavak.
A fehérjéket három csoportba soroljuk.
1. Oldhatóság vízben:
Albuminok - vízben oldhatóak és sós oldatok.
Globulinok - kevés vízben oldódik és oldható sós oldatokban.
A prolaminok vízben nem oldódnak és vizes alkoholban oldódnak.
A glutelenek - vízben nem oldhatók, sós oldatok és vizes alkohol oldatban oldódnak savak és lúgok oldatában.
A szkleroproteinek vízben, híg sóoldatokban, vizes alkoholban és savak és lúgok oldatában oldhatatlanok.
2. A proteideket hidrolízissel osztályozzák:
Nukleoproteinek - fehérjékhez és nukleinsavakhoz hidrolizálva.
Foszfoproteinek - fehérjékhez és foszforsavhoz hidrolizálva.
Glükoproteinek - fehérjékhez és szénhidrátokhoz hidrolizálva.
Kromoproteinek - fehérjékhez és színezékekhez hidrolizálva.
3. Minden fehérje a szervezetben lévő funkciók szerint osztályozható:
Az anyagcserét szabályozó fehérjék.
Az aminosavakhoz hasonlóan a fehérjék amfoter jellegűek és egy izoelektromos pontot tartalmaznak. A fehérjék izoelektromos pontjának elhelyezkedése nagymértékben eltérhet a savtól az erősen lúgosig.
Valamennyi fehérje optikailag aktív. Legtöbbjüknek van egy bal forgása.
A fehérjék számos minőségi színreakciót mutatnak:
1. Xantoprotein salétromsavval. A salétromsavval kezelt fehérjék sárga színűek.
2. Biuret rézsókkal alkáli jelenlétében. A fehérjék lila színt adnak a komplex só kialakulásának köszönhetően.
3. Millon reakciója. A higany-nitrát dinitrogén-savban készült oldatával a fehérjék vörös színűek.
4. Szulfidril. Amikor a fehérjéket nátrium-plumbit oldattal melegítjük, egy fekete ólom-szulfid csapadék képződik.
A fehérjéket 26 aminosavból álló maradékból állítjuk elő. Az aminosavak felcserélhetők, amelyeket a szervezet szintetizálhat és pótolhatatlan, amelyet az emberi test nem szintetizál. Például izoleucin és treonin.
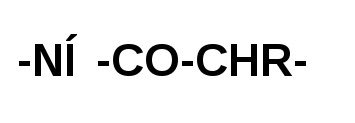
Az aminosavmaradékok amidkötésekkel kötődnek a fehérjemolekulához. A fehérjék amidkötését peptidkötésnek nevezik:
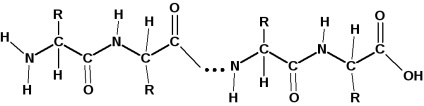
Egy aminosavmolekula karboxilcsoportja egy amidot képez a szomszédos aminosavmolekula aminocsoportjával való kölcsönhatás révén. Egyéni peptidegységek:
egymástól csak az "R" gyökök különböznek egymástól az α-szénatomon.
Több aminosavmaradékot tartalmazó vegyületeket peptideknek nevezünk. A nagyszámú peptid egységet tartalmazó vegyületeket polipeptideknek nevezik.
Abban a vizsgálatban, polipeptidek, elsősorban megtudja, hogy mely aminosavakat a makromolekula épül, és amely aminosav az N-terminális (szabad amino-csoport), és amely egy C-terminális (szabad korboksilnaya csoport).
A fehérjéket teljesen hidrolizálják aminosavakká koncentrált sósavval vagy 2% -os sósavval melegítés és emelt nyomás mellett. A fehérjék hidrolízisét lúg hatása alatt végezhetjük. A reagens választása attól függ, hogy milyen specifikus aminosavakat kell kinyerni a fehérjemolekulából.
Az N-terminális aminosav meghatározása
2,4-dinitro-fluor-benzol:
Amikor a 2,4-dinitrofluor-benzol reagál a peptiddel, a fluorat nukleofil módon helyettesíti a terminális aminocsoport. Ezután a peptidet hidrolizáljuk. A terminális aminosav reakciótermékét 2,4-dinitro-fluor-benzollal izoláljuk, és a savot azonosítjuk. Azokban az esetekben, amikor a 2,4-dinitrofluor-benzol nem alkalmazható, fenil-izotiocianátot használnak.
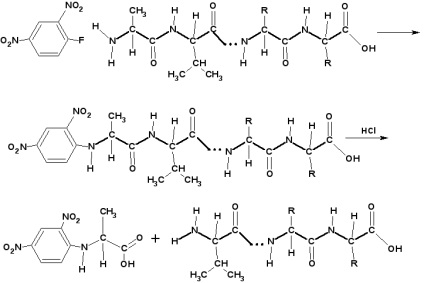
A C-terminális aminosav meghatározása:
A C-terminális aminosav (szabad hidroxil) meghatározása céljából a peptidet 100 ° C-on több órán keresztül hidrazinnal melegítjük. Ebben az esetben minden aminosav, kivéve a terminálisat, hidrazidokat képez:
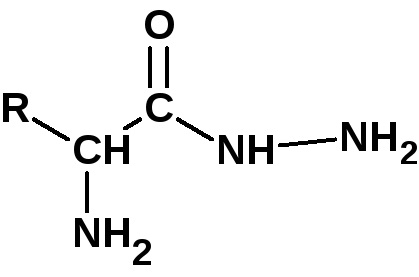
Egy olyan aminosavat, amely nem képezi a hidrazidot, izolálják és azonosítják.
Egy egyszerűbb módszer egy olyan karboxipeptidáz enzim alkalmazása, amely csak a C-terminális aminosav peptidkötését képes megkötni. Ez azonosítani és azonosítani.
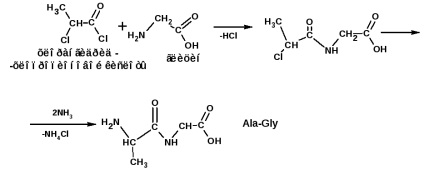
A polipeptidlánc konstrukcióját E. Fischer módszerével végezzük. Az eljárás az a-halogén-szubsztituált savak savkloridjain alapul. Például, meg kell szerezned a láncot:
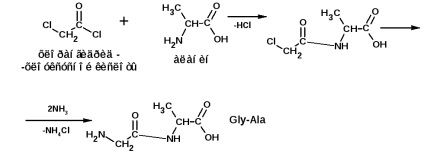
és alnyingelinvalin (Ala-Gly-Val):
A polipeptidben kovalensen kapcsolt aminosavak szekvenciája a protein úgynevezett primer szerkezete. De maga a polipeptid még nem fehérje. A peptidek nem képesek működni. Végezzen el olyan funkciókat a szervezetben, amelyek több polipeptidláncból álló komplex rendszerekhez képesek, bizonyos módon összekapcsolva egymással. A polipeptidláncok által alkotott supramolekuláris struktúrákat a protein másodlagos, tercier és kvaterner szerkezete jellemzi.
A másodlagos szerkezet a peptidkötéses oxigénnel kötött karbonilcsoport és az aminocsoport hidrogénje közötti hidrogénkötéseknek köszönhető. Ha a karbonil- és aminocsoport különböző polipeptidláncokhoz tartozik, akkor ezt a másodlagos szerkezetet p-szerkezetnek nevezzük. Ha a karbonilcsoport és az aminocsoport ugyanazon polipeptidláncba tartozik, akkor egy ilyen szekunder szerkezetet α-szerkezetnek nevezünk. Az α-struktúra következménye egy polipeptid lánc létezése hengeres henger formájában. Egy maradék hossza 1,5 A 0. A spirálmagasság hossza 5,4 A 0. Az a-hélix hidrogénkötései alakulnak ki minden első és negyedik aminosav között.
A fehérje tercier szerkezete több a-hélix hajtogatásának vagy hajtogatásának köszönhető. Ebben az esetben a spirálok egymáshoz közel helyezkednek el az oldallánc amino-, hidroxi- és karboxilcsoportjai által alkotott hidrogénkötések, valamint a diszulfidkötések és elektrosztatikus formálás következtében.
A kvaterner szerkezet több polipeptidlánc aggregátumaként van kialakítva, amelyek másodlagos és tercier szerkezettel rendelkeznek. A polipeptidláncok a kvaterner szerkezetben megmaradnak ugyanolyan erőkkel, mint a tercier struktúrában.
A fehérje primer szekunder, tercier és kvaterner szerkezetének elpusztítását denaturációnak nevezzük. A denaturáció termikusan (fűtés), kémiailag, mechanikusan stb. Okozhat. Ugyanakkor a denaturáció visszafordítható és visszafordíthatatlan. Irreverzibilis az elsődleges és másodlagos szerkezet megsemmisítésével járó denaturáció. Pusztulásuk után a fehérje nem spontán visszaáll. Például a fehérjék hidrolízise vagy főzés tojás vagy hús, tojásfehérje forralása. A tercier és kvaterner szerkezet denaturálása reverzibilis. A pusztításuk után a fehérjék spontán visszaállhatnak a biológiai funkciók visszatérésével. Például hajszálcsiszolók (termikus denaturáció) vagy kémiai perm.