Fémek korróziójának előadása
Vegyi és elektrokémiai korrózió. Anódos és katódos folyamatok elektrokémiai korrózióban. Elektrokémiai korrózió hidrogénnel és oxigén depolarizációval. Korrózió különböző fémek érintkezésével. A fémszerkezetek korrózióvédelmének fő módjai. Anódos és katódos fém bevonatok. Védelmi védelem, katód védelem elektrokémiai módszerei.
Korrózió - spontán nemkívánatos fém pusztítás a környezetével való kölcsönhatás eredményeként.
Korrózió esetén a fém (redukálószer) oxidálódik az oxidálószerrel, amely a tápközeg komponense, azaz a korrózió egy oxidációs redukciós folyamat.
A korróziós folyamat mechanizmusa révén a vegyi és elektrokémiai anyagokat elszigetelik az orrozióhoz.
A kémiai korrózió nem elektrolitos közegben történik, az elektronok fémektől az oxidálószerig történő közvetlen átmenetéig. A kémiai korrózió leggyakoribb típusa a gáz-korrózió és a korrózió nem elektrolitos közegben (benzin, olaj, szerves oldószerek).
A gáz korrózióját agresszív gázok (klór, oxigén, kén-oxidok, nitrogén) és gőzök figyelik meg, a nedvesség kondenzációja nélkül a fém felületén, általában magas hőmérsékleten. Ez a fajta korrózió alatt vágószerszámok, gázturbinás kések, sugárhajtású alkatrészek kerülnek végrehajtásra.
A nem elektrolitos közegben fellépő korrózió egyik példája a folyékony üzemanyag korróziója (belső égésű motorok alkatrészeinek megsemmisítése stb.).
Az elektrokémiai korrózió elektrolitos közegben történik, különbsége az oxidációs és redukciós folyamatok szétválasztása az űrben. Ez a fajta korrózió gyakoribb, a talaj, a folyó és a tengervíz fémszerkezetei, sók, savak, lúgok, az adszorbeált nedvességfilmek alatt lévő atmoszférában stb. Elektrokémiai korrózió akkor jelentkezik, ha potenciális különbség van a fémfelületek között.
Az elektrokémiai korrózió fő okai (potenciális különbségek előfordulása)
különböző fémek érintkezése,
mikrostress egy fémtermékben,
a fémfelület mechanikai vagy hőkezelésének heterogenitása,
nem fémes zárványok és szennyeződések (grafit, karbidok, festékfoltok a felületen stb.) jelenléte,
a fémfelületek hőmérsékletkülönbsége.
A fém ellenálló képességét korróziós médiumnak nevezik korrózióállóságnak. A korrózióállóságot kvalitatív és kvantitatív módon határozzák meg - a korrózió sebessége az adott körülmények között, csoportonként vagy az elfogadott skála szerinti rezisztencia-skálával. A magas korrózióállóságú fémeket korrózióállónak nevezik.
Anódos és katódos folyamatok elektrokémiai korrózióban
Az elektrokémiai korrózió során két egymással összefüggő folyamat különböztethető meg: anódos és katódos.
Az anódos eljárás - a fém oxidációja, az adott tápközegben kisebb potenciálú termékek szegmensein halad át. Az anódhelyek megsemmisülnek.
A katódfolyamat - az oxidálószer redukciója az elektrolit oldatában vagy olvadékában - olyan termékek körzetében fordul elő, amelyek nagyobb potenciállal rendelkeznek egy adott közegben. A katódoldalak nem kémiailag megváltoznak. Elektródákként szolgálnak az anód régiókból az oxidálószerhez, ezáltal növelve az anód régiók korrózióját. Ezt részletesebben az alábbiakban ismertetjük konkrét példákon.
A korrózió oxidálószereit általában depolarizátoroknak nevezik. A leggyakoribb oxidálószereket - az oldott oxigént és a hidrogénionokat (sav vagy víz) érintő korróziót megfelelő módon oxigén- és hidrogén depolarizációnak nevezzük. A katódfolyamatok egyenleteit a táblázat tartalmazza.
A katódos folyamatok korróziós egyenletei
Az oxigén oxidációs tulajdonságai magasabbak, mint a hidrogénion (vagy víz) oxidáló tulajdonságai. Az oldat oxigén jelenlétében a korrózió nem feltétlenül oxigén depolarizációnak tulajdonítható, mivel az oldott oxigén koncentrációja általában kicsi. Azt tapasztaltuk, hogy a pH = 7 értéknél, azaz. semleges és lúgos oldatokban az eljárás általában oxigén depolarizációval - egyenlet (4), savas közegben - főként hidrogén depolarizációval - az (1) egyenlet.
A korrózió, mint bármely oxidációs redukciós folyamat, csak azzal a feltétellel végezhető el, hogy az oxidálószer potenciálja nagyobb, mint a redukálószer (az anódszakaszok fémje) potenciálja.
Korrózió különböző fémek érintkezésével
Az elektrokémiai korrózió egyik leggyakoribb esete a folyamatok, amikor két fém érintkezik az elektrolit oldatban. Az ilyen párokat (M1 és M2) galvano-gőznek nevezik, és M1 / M2 jelzéssel.
A galvanoidokat tartalmazó korróziós folyamat egyszerűsített leírását célszerűen a következő sorrendben végezzük.
Írja le a fémek potenciáljának értékeit egy adott közegben, határozza meg az anódot (a potenciál kisebb értékével rendelkező fém) és a katódot (fém - nagyobb potenciálértékkel).
Írja le az esetleges oxidálószer (depolarizáló) potenciálját.
Értékelje a folyamat lehetőségét az oxidálószer és a redukálószer potenciáljának összehasonlításával.
Írja fel a fél reakcióegyenleteket:
anódos anyag anódos oxidációja;
az oxidálószer katódos redukciója.
Összegezzük a fél reakciók egyenleteit, írjuk le az oxidációs-redukciós reakció ionos és molekuláris egyenleteit a galvano-korrózió során.
Annak érdekében, hogy bemutassuk az elektron elmozdulást a hagyományos galvanikus párt rendszerben.
Vegyük figyelembe az ónozott bevonat korróziós folyamatát, feltéve, hogy a bevonat folytonosságát az oldott oxigén hiányában savas közegben zavarják.
Ha a bevonat folytonosságát megzavarják, galvano-gőz keletkezik, feltételes rendszere
A fémek potenciáljának értékei
Galvanikus gőz (A) - anód - oxidálószer redukálószer;
Sn a galvanikus pár katódja (K).
Lehetséges oxidálószer - savas hidrogén ionok,
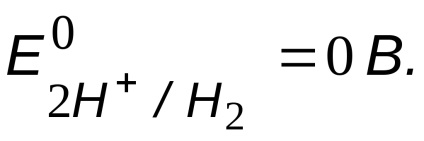
Az oxidálószer és redukálószer potenciál összehasonlítása
, azaz a vas korróziója lehetséges.
A: Fe - 2ē = Fe 2+ - oxidáció
K (Sn): 2H + + 2ē = H2 - redukció
Ion és molekuláris egyenletek:
Fe + 2H + = Fe2 + + H2
Az elektronmozgás iránya a hagyományos galvánpár rendszeren (egy kisebb potenciálú, nagyobb potenciállal rendelkező helyszínről):
A galvanoparban a savas közegben lévő ón-vas megsemmisíti a vasat, a hidrogén felszabadul az ónon.
Tekintsük a korróziós folyamatot oxigén depolarizációval Mg / Fe galvángőz nedves levegőjében.
A galvánpár feltételes ábrája
A fémek potenciáljának értékei
.
Mg - a galvángőz (A) - redukálószer anódja, oxidálódik.
Fe a galvanikus pár katódja (K).
Oxidálószer korrózióhoz oxigén depolarizációval - oxigén,.
A: 2 Mg + 2H 2O -2c = Mg (OH) 2 + 2H + oxidáció
K (Fe): 1O2 + 2H20 + 4ē = 4OH - csökkentés
2Mg + 4H2O + O2 + 2H20 = 2Mg (OH) 2 + 4H + + 4OH ¯
Az elektronok mozgásának iránya a hagyományos galvánpár rendszeren:
Különböző fémek érintkezésekor az aktívabb fém oxidálódik, megsemmisül. A kevésbé aktív fémekkel való érintkezés fokozza az aktívabb fém korrózióját. Az aktívabb fémekkel való érintkezés megvédi a kevésbé aktív fémt a korrózió okozta károsodástól.
A fémek korrózióvédelmére szolgáló módszerek
lakkok, festékek, zománcok, bitumen, műanyagok, kerámiák, gumi, gyanták és egyéb bevonatok fizikai módszerekkel;
oxid, foszfát és más, fémekkel való kezeléssel előállított fóliák.
Anódos bevonatok - olyan termékbevonatok, amelyek aktívabb fém, vagyis egy adott táptalajban kisebb potenciállal rendelkező fém, mint a fém bevonatának potenciálja, például horganyzott vas.
A katódbevonatok egy kevésbé aktív fémből készült termék bevonata, vagyis egy olyan fém, amelynek nagyobb potenciálja van egy adott közegben, mint a fém bevonatának potenciálja; Példák: rézbevonat, acél nikkelezés.
A pórusokban előforduló folyamatok, illetve a fém bevonatok folyamatosságának zavarai a rajzon láthatóak.