Számítási CH4 molekula
Jelentés a laboratóriumi munka 1
Student-féle t. O-24
Ab initio kvantumkémiai számítások a CH4 molekulák.
1. CÉLOK KISZÁMÍTÁS.
A cél a számítás: meghatározása kiválasztásának kritériumait és tanulmány a konstrukciós elvei a tábor szabványos bázisra kiszámításához molekuláris rendszerek. A tanulmány szerint az eredmények értelmezésében kiszámítása és bemutatása a molekula vektor tulajdonságok ezek alapján. Ismerete szoftver GAMESS összetett.
számítási feladat: válassza ki a lehető legkisebb optimális alapját ab initio számítások a kötéshosszak és kötésszöget CH4 molekulák GAMESS szoftver rendszer pontossággal 0,01 A a kötéshosszak és 1 ° C-on kötésszöget, hasonló a kísérleti. Alapján a számítási eredményeket, hogy értékelje a stabilitás és a meghatározott tényezők hasadó-reaktivitás a molekula.
2. leírása és indoklása, a számítási módszer.
Kiszámítása CH4 molekulák megvalósított szoftver GAMESS komplexet Pople szabvány alapján meghatározott 6-31G *. Ez alapján a vegyérték osztott. Valence MO jelentése lineáris kombinációi 2 tömörített kombinációja Gauss pályák, spanning MO - 1.. Az egyes nem-hidrogén atomot is középre a polarizációs komponens 6 d-funkciókat. Így, hogy számítania molekulyCH4 alapján áll 23 funkciók:
1 * C (1 (1s) + 2 * 4 (2s + 2p) + 6 (3d)) +
4 * H (2 (1S) = 23
Minden két-exponenciális vegyértéke bázisfüggvények (6-31 G *), spanning 1s MO - egyszeres exponenciális. s- és p-tömörítés megfelelő (egy formális szempontból) egy főkvantumszám n, vannak hajtogatva, SP-shell [(2s + 2p), (3S + 3p)], és mutatjuk be a különböző lineáris kombinációi primitívek azonos Gauss eksponetsialnymi szorzók.
Minden spanning kompressziós exponens képviseli egy lineáris kombinációja Gauss primitívek 6 (6 -31G *). Mindegyik sajtolási kitevőt vegyérték elektronok képviseli egy lineáris kombinációja 3 vagy (6-3 1G *), vagy az egyik (6-31 G *) Gauss primitívek.
6-31G * alapján a legkisebb a lehetséges bázis kiszámításának kötéstávolságok és a kötésszögek CH4 molekula kísérleti pontossággal. Hozzáadása d-polarizációs függvények (6-31G *) figyelembe veszi a polarizáció a „laza” elektronhéjak a halogénatomok képződése során kötések (kötéshosszak csökkenti
3. értelmezése a számítás.
1. értékelése a molekula stabilitásának.
Entalpiája képződése CH4 molekulák egyszerű anyagok is:
f H 0 (CH4) = E (CH4) - 1 / 2E (C2) - 2E (H2) = -40,19517 + ½ * 75,37903 + 2 * 1,12683 -0,25184 au = = --158,032 kcal / mol -661,205 kJ / mol
Következtetés: A molekula CH4 stabil a szokásos körülmények között.
2. tulajdonságai CH4 molekula kötvények
Finomított geometria és kötés megbízások CH4 molekula:
4.Opredelenie nukleofil és elektrofil tulajdonságait CH4 molekulák.
LUMO energia a CH4 molekula pozitív (0,2571 AU).
Következtetés. CH4 molekula nukleofil.
5. meghatározása keménysége és lágysága a molekula.
HOMO CH4 molekula háromszor degenerált. A különbség az erő és energia több alacsonyan fekvő MO alacsony (0,3984 AU).
Következtetés. CH4 molekula yavlyaetsyazhestkim reagenst.
A merevség a molekula CH4:
=
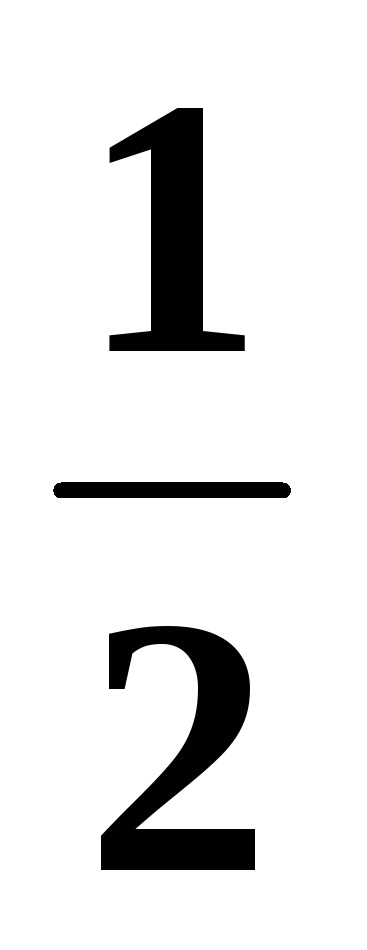
A lágyság a CH4 molekula:
6. meghatározása a helyzet a reakció központok.
Reaktivitás CH4 molekula, mint egy merev reagens határozza díjakat a atomok, max. A töltés eloszlása atomi Mulliken következő:
A maximális negatív töltéssel rendelkező atom C.
Következtetés. C atomok - a legvalószínűbb központok elektrofil támadást.
7. Értékelés oldhatósági.
Elektromos dipólmomentum CH4 molekula kis mérete 0,00 D.
Következtetés: CH4-molekula előnyösen oldódnak nem poláros oldószerekben.