Előnyei és hátrányai kezelés monoklonális antitestek IBD (Crohn-betegség)
Az elmúlt években, köszönhetően a molekuláris és a sejtbiológia sikerült megfejteni sok a mechanizmusok a különféle betegségek patogenezisében, beleértve a rákot és az autoimmun. Különösen, lehetséges volt, hogy meghatározzuk a jelei a malignus fenotípus: érzékenység növekedést jeleket, hogy növelje a tolerancia-igibitornym jelek, elleni védelem a programozott sejthalált (apoptózis), korlátlan osztódási potenciái, angiogenezis, szöveti invázió és metasztázis. A megjelenése ezeket az adatokat a lendület kíván alapvetően új terápiás eljárást, pont, amelynek célja, hogy cselekedni legfontosabb eleme a kóroki lánc kóros folyamat kapcsolatban kapott a közös név a „célzott kezelés”.
A monoklonális antitestek alkalmazása, mint terápiás szerek a gyógyászat volt stratégiai pont változást a koncepció a kezelés - a nem-specifikus egy adott (célzott) terápiát. Fejlesztése ellen irányított monoklonális ellenanyagok azonosítására és kölcsönhatás specifikus szerek származó celluláris célokra vagy jelátviteli, amely végül kell a sejt pusztulásához vezetnek különböző mechanizmusok útján. A monoklonális antitestek, ellentétben a hagyományos gyógyszerek, nagyon specifikusak bizonyos célokat. A mai napig, azok a legtöbb széles körben használják a onko-hematológiai és szolid tumorok kezelésére és autoimmun betegségek. Korábban összpontosított citolitikus hatása a monoklonális antitestek által immunválasz stimulálásával. A közelmúltban, a hangsúly a fő célokat szerepet játszanak a daganatsejtek növekedésének szabályozása és célzott eljuttatása a citotoxikus szerek. Azt mutatják, hogy a terápiás ellenanyagok mellett alkalmazott közvetlen végrehajtott műveletet immun-közvetített effektor funkciókat, beleértve az ellenanyag-függő és komplement-dependens citotoxicitást.
Így, monoklonális antitestek hozzájárulhat aktiválását tumorspecifikus immunválasz.
Jelenleg FDA számos tartalmazó készítmények monoklonális antitest (táblázat. 1). A gyógyszeripari vállalatok aktívan folytat klinikai vizsgálatok bővíteni a jelzéseket a jóváhagyott gyógyszerek.
A monoklonális antitestek FDA engedélyezett
Receptor glikoprotein IIb / IIIa
Akut koronária szindróma
tumor nekrózis faktor-a
Gyulladásos betegségek (többnyire autoimmun)
A krónikus limfoid leukémia
IL-2-receptor a-
vaszkuláris endoteliális növekedési faktor
Az epidermális növekedési faktor receptor
IL-2-receptor a-
A komplement rendszer C5
Gyulladásos betegség, beleértve a paroxizmális hemoglobinuria
Adhéziós receptorok CD11a
Gyulladásos betegségek (psoriasis)
Non-Hodgkin-limfóma (s ibrium-90 vagy indium-111)
tumor nekrózis faktor-a
Gyulladásos betegségek (többnyire autoimmun)
Ragasztó receptor VLA-4
A immuno-gyulladásos megbetegedések (elsősorban autoimmun, és elsősorban, sclerosis multiplex)
Immunglobulin E (IgE)
A immuno-gyulladásos megbetegedések (elsősorban asztma)
Epitóp fehérjét f RSV
Vírusfertőzés (légúti óriássejtes vírus (RSV)
Az epidermális növekedési faktor receptor
vaszkuláris endoteliális növekedési faktor
Az epidermális növekedési faktor receptor
az emlőrák
Azonban, ha a használat a Rituximab (Rituxan / MabThera) kezelésére a B-sejt neoplasia igazoltuk nem csak a hatékonyság, hanem a biztonsági, a meta-analízise a inhibítorok alkalmazása citokinek és növekedési faktorok (mint kulcsfontosságú cél) ad kevésbé pozitív képet.
A fejlesztés az ilyen szövődmények meglehetősen kiszámítható. A sejteket az immunrendszer és más szomatikus sejtek kölcsönhatásban vannak széles mediátorok, különösen a citokinek és a növekedési faktorok. Ez a kölcsönhatás jellegénél kaszkád reakció és szabályozására a visszacsatolás típusú. A fejlesztés a kóros folyamat megsérti a kényes egyensúlyt, ami szabályozási zavarának sejt-sejt kölcsönhatások, amely megmutatkozó formájában immun gyulladásos és autoimmun folyamatok a tumornövekedés, stb
A példaként hatásának nekrózis faktor-alfa tumor (TNFalfa) ismert mechanizmusok megpróbáltuk megfogalmazni a követelmények terápiás szerek, amelyek blokkolják a TNF, értékeli és a megfelelő anti-TNF terápiás antitestek (TAT) ezeknek a követelményeknek.
A legalaposabban vizsgált első, mely eljárás során és a transzmembrán-TNF-receptor TNF-R1 (p55). Anélkül, hogy a funkciók a strukturális és funkcionális tulajdonságait kölcsönható molekulák, megjegyezzük, hogy a TNF kötődését a TNF-R1 receptor aktiválását eredményezi az utóbbi. Attól függően, hogy a típusát és állapotát a sejtek, és a mikrokörnyezet aktiválása a TNF-R1 eredményez egy lehetséges megvalósítása jelátviteli (ábra. 1).
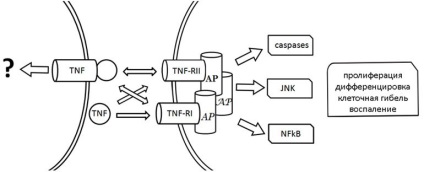
1. ábra TNF-függő jelátviteli utak. TNF-RI és TNF-RII receptorok TNF, AP - adapter fehérjék
Abban az esetben, citotoxikus jelzés mutatja, hogy a fizikai asszociáció a TNF-R1 és adapter fehérjék TRADD / FADD elindítja az úgynevezett kaszpáz kaszkád (proteolitikus enzimek aktiválását), amelyek a legtöbb esetben megszűnik lebontással különböző intracelluláris célok, beleértve a nukleáris DNS-t és a sejthalált. TNF-R1 kölcsönhatás más adapter fehérjék (TRAF2, RIP, NIK, Fan et al.) Serkentik az aktiválását különböző intracelluláris proteinek, különösen a transzkripciós faktor NF-ĸB, JNK, kaszpázok, szfingomielináz, és mások. A sejtek szintjén, TNF aktiválás -R1 halált is okozhat, a sejtburjánzás és differenciálódás. Továbbá, azt találtuk, hogy az aktiválási a TNF-R1 morfogenetikus befolyásolja az ilyen jellemzők, mint alakja és motilitását sejtek, sejt-sejt kapcsolatokat.
Kölcsönhatás transmebrannogo TNF és a TNF-R2 (p75) egy másik típusú kijelző sejt TNF hatások (ábra. 1). Úgy tartják, hogy ellentétben a TNF-R1, képes aktiválni történő kötődésekor mind mTNF és rTNF, TNF-R2 aktiválja elsődlegesen mTNF. Ennek megfelelően, a kialakulását rTNF-TNF-R2 komplex akkor tekinthető, mint a módszer a növekvő lokális rTNF koncentrációja a sejtmembránon továbbítja, hogy a TNF-R1 ( «ligandum-elhaladó»), és / vagy mint eszköz részleges / versenyképes kölcsönhatást blokkoló mTNF és TNF-R2. Mivel abban az esetben, TNF-R1, TNF-R2 aktivált képezhet társult különböző adapter fehérjék (TRAF1, TRAF2, RIP, FADD), és ezáltal elindítsa aktiválását különböző jelátviteli utak, ami halált vagy sejtburjánzás.
Az általános kép celluláris TNF hatásainak bonyolítja az a régóta ismert tény, hogy a limfotoxin-alfa (LTalfa), más TNF-család citokin, amely képes kölcsönhatásba lépnek a tumor nekrózis faktor. Így, TNF befolyásolhatja a működését egy másik citokin szabályozása által a kötési és aktiválási.
Fiziológiai megnyilvánulások a TNF aktivitás rendkívül széles. Itt bemutatunk néhány példát az intézkedések a TNF.
Abban az esetben, a szisztémás TNF-gátló, mint a jelenleg történik, például az autoimmun betegségek, az egyik meg kell várni egy éles csökkenése a koncentrációja oldható TNF egy beteg vérében és blokkolja a transzmembrán formája a citokin. Gyulladáskeltő TNF hatásainak lesznek ideiglenesen nyomni, a TNF-függő hiperplázia synoviociták is blokkolva lesz, ha van egy, például a rheumatoid arthritis. Azonban, gátlása gyulladásos folyamatok szintjén TNF elhagyja a test szinte a „KI” az immunrendszer annak minden következményével együtt, mellett jól ismertek; elnyomja a TNF-függő apoptózis növeli a túlélés valószínűségét és a szaporodás a transzformált sejtek, stb végződő növekedése a beteg testsúlyától és állandó álmosság.
Így a kezelés használt anti-TNF alapú TAT egyáltalán nem felel meg a kritériumoknak (lásd. Fent). Blokkolásával az egyik a „kulcs” egységek patológiás folyamat, a kívánt hatást érjük el a legjobb átmeneti, mivel a kiegészítő tartalmazza a „nem-core” tényezők, és a háttérben a súlyos mellékhatások. Ezért monoklonális antitest terápia, annak ellenére, hogy a kereskedelmi vonzerejét, véleményünk szerint, nem egy ígéretes területe a hosszú távú kezelés. Nyilvánvaló, hogy megértsék, és a fejlesztők az új gyógyszerek.
Modern protokollok alapulnak kombinált megközelítés a kezelésre, beleértve a vakcinákat, a kemoterápia, a monoklonális antitestek. Középpontjában ez a megközelítés az állítólagos terápiás szinergia. Továbbá, a lehetőségét, hogy a rekombináns peptid ligandumok konjugálva citotoxinok penetráló a sejteken belül, kis molekulájú inhibitorok, amely működhet, az intracelluláris receptorok és megszakitási tartomány jelátviteli folyamat, kis RNS (iPNA). A azonosítása őssejtek számos tumorban biztosít új célokat felelős a progresszió és metasztázis.
Így csak egy átfogó megközelítés, amely figyelembe veszi a különböző patogenetikai kapcsolatok és gyógyszerek különböző osztályai, amely képes biztosítani a kívánt hatást, minimális kockázatot jelent a beteg számára.