Móltömeg a hidrogén-szulfid (H2S), és példák a általános képletű
A moláris tömege hidrogén-szulfid
A hidrogén-szulfid (monosulfane) normál körülmények között színtelen gáz.
Termikusan instabil. A szerkezet a molekula ábrán látható. 1.Ploho oldódik hideg vízben. A telített oldatot (0,1 M), az úgynevezett „hidrogén-szulfid víz”, amely zavarossá válik állás levegőben. Mutat gyenge savas tulajdonságokkal. Az ISI egy erős redukálószer.
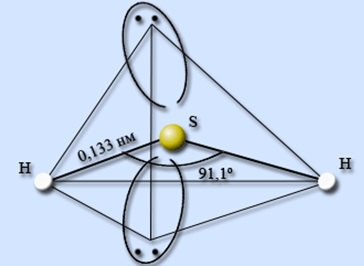
Ábra. 1. A szerkezet a hidrogén-szulfid-molekulák jelezve a kötés közötti szög kötvények és hosszúságú kémiai kötések.
Molekuláris képlet a hidrogén-szulfid - H2 S. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Úr (H2S) = 2 x Ar (H) + Ar (S);
Úr (H2S) = 2 × 1 + 32 = 2 + 32 = 34.
Móltömeg (M) - a súlya 1 mol hatóanyagra vonatkoztatva. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy a moláris tömege hidrogén-szulfid 34 g / mol.
Példák problémák megoldása
Tedd képletű hidrogén, kén és oxigén, ha a tömegarányai elemek benne: ω (H) = 2,04%, ω (S) = 32,65%, ω (O) = 65,31%.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (H) „y” (kén), «z» (oxigén). Ezután a mólarány a következő lesz (az értékek a relatív atomi tömegeket vett Mendeleev Periódusos Táblázat egész számra kerekítve):
x: y: z = ω (H) / Ar (H). ω (S) / Ar (S). ω (O) / Ar (O);
x: y: z = 2,04 / 1. 32.65 / 32: 65,31 / 16;
x: y: z = 2,04. 1,02: 4,08 = 2. 1. 4.
Ezért általános képletű hidrogén, kén és oxigén lesz a forma H2 SO4. Ez a kénsav.
Tedd Formula két oxid a réz, ha a tömeghányad réz, amelyben 79,9% és 88,8%.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Azt találjuk, tömeghányada az egyes réz-oxidok:
ω1 (O) = 100% - ω1 (Cu) = 100% - 79,9% = 20,1%;
ω2 (O) = 100% - ω2 (Cu) = 100% - 88,8% = 11,2%.
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (réz) és az „y” (oxigén). Ezután a mólarány a következő lesz (az értékek a relatív atomi tömegeket vett Mendeleev Periódusos Táblázat egész számra kerekítve):
x: y = 79,9 / 64. 20,1 / 16;
x: y = 1,25. 1. 1 = 1,25.
Formula így az első réz-oxid lesz formájában CuO.
x: y = 88,8 / 64. 11.2 / 16;
x: y = 1,39. 2. 1 = 0,7.
Formula így a második réz-oxid lesz formájában Cu2 O.