Kémiai víz katalógus
VÍZ (hidrogén-oxid), H2 O, molekulatömege 18,016, a legegyszerűbb stabil vegyület hidrogén oxigénnel. Szagtalan folyadék, íze és színe.
Distribution jellegű. Víz - az egyik legelterjedtebb a földön vegyületek. A vízmolekulák talált a csillagközi térben. A víz egy részét az üstökösök, a legtöbb bolygó a Naprendszer és a műholdak. Max a víz a föld becsült 1,39 x 10 18 tonna, a nagy része benne van a tengerek és óceánok. Max használatra rendelkezésre álló édesvíz folyók, tavak, mocsarak, és a tartályokat 2 x 10 4 t. Mass antarktiszi jég, Antarktisz és Highlands 2,4 × 10 16 t, nagyjából azonos számú felszín alatti, és csak egy kis rész - friss. A mély rétegeibe a föld tartalmaz sokkal több (nyilvánvalóan, nem kevesebb, mint egy sorrendben) vizet, mint a felületen. A légkör kb. 1,3 × 10 13 t vízben. A víz egy része a sok ásványok és kőzetek (agyag, gipsz, stb) jelen vannak a talajban, kötelező. alkotóeleme minden élő szervezet számára.
Molekuláris szerkezetét és fizikai tulajdonságait. Hidrogén és oxigén atomok vízmolekula helyezkedik a sarkokban egy egyenlő szárú háromszög a hossza a O-H 0,0957 nm; kötésszög O-H-H 104,5 °; dipólusmomentuma 6,17 * 10 -30 * m Cl; molekuláris polarizálhatóságot 1,45 * 10 -3 nm 3; átlagos kvadrupol pillanatban - 1,87 * 10 -41 m 2 Cl * ionizációs energiája 12,6 eV, proton affinitása 7.1 eV. Amikor a kölcsönhatás a vízmolekula másokkal. Az atomok, molekulák és ionok, beleértve más vízmolekulák kondenzálására. fázis, ezek a paraméterek megváltoznak.
Néhány jellemző paraméterek a víz tulajdonságait különböző állapotaiban aggregáció atm. nyomás alábbiakban megadott (lásd az 1. táblázatot is és az 1. ábrán, amelyek a domain lét különböző módosításokat jég ...):

Nat. víz tulajdonságok rendellenes. Olvadó jég atm. nyomás csökkenése kíséri a térfogat 9%. A hőmérsékleti együttható a volumetrikus expanzióját jég és folyékony víz negatív T-PAX rendre alatt -210 ° C-on és 3,98 ° C-on Fajhő ° C-on olvadó csaknem páros és 0-100 ° C-on majdnem független a hőmérséklet (van egy minimális 35 ° C-on). Minimális ISO termodinamikailag összenyomhatóságot (44,9 x 10 -11 Pa -1) megfigyelt 46 ° C-on, egyértelműen kifejezve. A kis nyomáson és hőmérsékleten legfeljebb 30 ° C, a víz viszkozitása csökken a nyomás növelésével. A magas dielektromos állandója és a dipólusmomentuma a víz határozza meg a jó oldóerővel poláros és ionos anyagokat. Mivel a magas értéke C °, és a víz, egy fontos szabályozója a klimatikus. a helyszíni körülmények, stabilizáló a hőmérséklet a felszínén. Továbbá, a közelsége a szög H-G-H a tetraéderes (109 ° 28 „) okoz lazasága struktúrák jég és folyékony víz, és ennek eredményeként, a rendellenes hőmérsékletfüggése a sűrűség. Ezért nem fagyasztható, hogy az alján nagy vízfelületek, ami lehetővé teszi a létezését bennük élet.
Táblázat. 1 - tulajdonságai a víz és a vízgőz egyensúlyi
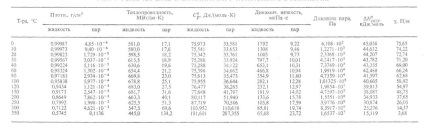
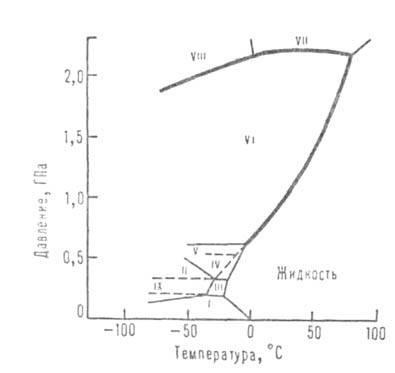
Ábra. 1. fázis diagramot a víz.
A kölcsönhatás vízmolekulák közötti. Structure kondenzált fázisok. A vízmolekulák jelentős di- pólus pillanatban erősen hatnak egymásra és más poláris molekulákat. Anyagok. Ebben az esetben a hidrogénatomok hidrogénkötéseket képeznek az O atomok, N, F, Cl, S et al. A gőz alacsony hőmérsékleten, és mérsékelt nyomás be egy kis mennyiségű (kb. 1% forrási hőmérsékleten, és atm. Nyomás) a víz dimerek ( számukra
15 kJ / mól), a távolság közötti oxigénatomok
0,3 nm. A kondenzált fázist egyes vízmolekula alkot négy hidrogénkötések, két - mint protondonor és két - egy protonakceptor. Az átlagos hossza ezen kötvények a kristályos. módosításai jég és ennek kristályos hidrátjai kb. 0,28 nm. Szög O-H. A megközelíti a 180 °. Négy hidrogénkötések vízmolekulák irányított megközelítőleg a csúcsai egy szabályos tetraéder (ábra. 2).
Szerkezet jég módosítások jelentése háromdimenziós rácsszerkezet. A sűrű módosítások VI-VIII, amelyek stabilak magas nyomások, akár kettőt kiemelünk ezen hálók, „ki” egymásba. A módosítások, a meglévő alacsony nyomásokon (jég Ih és Ic) a H-O-H szinte egyenes vonalú, és irányított lényegében a csúcsai egy szabályos tetraéder. A variánsok II-VI kommunikációs ívelt, és a szögek között azok eltérjenek a tetraéderes, amely növeli a sűrűsége, mint a sűrűsége a hagyományos jég.
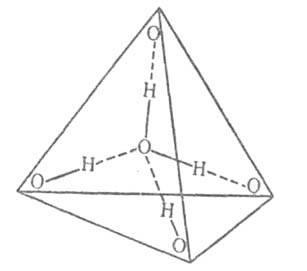
Ábra. 2. reakcióvázlat tetraéderes. összehangolása vízmolekulák; folytonos vonalak - kovalens kötés; szaggatott vonalak - hidrogénkötések.
De a sűrűsége módosítás II-VI lényegesen kisebb annál, hogy van a jég a sűrű molekulákat. Csak módosítások VII és VIII elért kellően nagy beültetési sűrűség: a szerkezetükben két jobb rács beépített tetraéderek (összehasonlítható a köbös jég alacsony hőmérsékleten Ic izostrukturális gyémánt.), Illeszti egymáshoz; miközben egy lineáris hidrogénkötések és koordináció. megduplázva a száma oxigén jut és 8. hely oxigén atomok a jég VII és VIII mint a elrendezése atomjaik vzheleze és még sokan mások. fémek. A normál (Ih), és köbös (Ic), a jég, és nem határozza meg a jég HI, V-VII molekuláris orientációs: Mindkét legközelebbi egy atom O proton formában ezzel kovalens kötés, amely lehet irányítani bármely két a négy szomszédos oxigénatomok a csúcsot a tetraéder. Dielektromos. permeabilitása ezen módosítások egyike magas (nagyobb, mint a folyékony víz). Módosítások II, VIII és IX orientációjú rendelt; ezek dielektromos állandója alacsony (kb. 3). Ice VIII egy rendezett elhelyezését protonok VII variáns jég és jég IX - jég III. Sűrűség orientációjú megrendelt módosítások (VIII, IX) közel a sűrűsége megfelelő rendezetlen (VII, III).
A három-dimenziós hálózati hidrogénkötések, beépített tetraéderek, léteznek folyékony víz és az egész tartományban az olvadási hőmérséklete, hogy a kritikus pont. Sûrûsödések olvadáspontú, mint abban az esetben a sűrű jeges módosítások magyarázható görbületi hidrogénkötéseket, és az eltérés szögek közéjük tetraéderes. A görbületi kapcsolatok növekszik hőmérséklet és nyomás, ami növeli a sűrűséget. C. és munkatársai. Hand, melegítésével az átlagos hidrogénkötések nagyobb lesz, miáltal a sűrűség csökken. A kombinált hatása két tényező magyarázza a víz jelenléte sűrűségű maximuma 3,98 ° C-on
Kémiai tulajdonságok. Csak egy kis része molekulák (25 ° C - körülbelül 1-től 5 x 10 9) Elektrolitikus téve. disszociációja a rendszer: H2 OH + + OH -. Proton H + egy vizes környezetben kölcsönhatásban a vízmolekulák, képeznek H3 O +. keverésre egy molekula H2 O H5 O2 +. O. A G távolság ilyen komplexek lényegesen rövidebb, mint a szokásos hossza a hidrogén közötti kötés semleges molekulák. De mivel a proton látszólag, nem éppen a közepén a rövidebb kapcsolat, és közelebb van az egyik O atomok lehet tekinteni, hogy a víz létezik a hidratált oxónium-ion H3 O +. Ez a jelenség fontos szerepet játszik a kémiai folyamatok játszódnak le az egyes rendszerek, beleértve a biológiai is. Pontosabban, a disszociációs víz - az oka hidrolízis és gyenge savak sói (vagy a) bázisok. A koncentrációja H + ionok és a kapcsolódó koncentrációja az OH - ionok -Fontos jellemzői vizes oldatok (lásd pH-érték.). Elektrolitos mértékben. disszociációs víz növeli jelentősen a hőmérséklet emelkedik.
A formáció az elemek a víz által a reakció H 2 + 1/2 O2 H2 O (H o MOD -242 kJ / mol gőz- és -286 kJ / mol a folyékony víz) alacsony hőmérsékleten a katalizátor távollétében rendkívül lassú, de a reakciósebesség meredeken emelkedik a hőmérséklet növelésével, és 550 ° C-on, az bekövetkezik robbanásszerűen. Azáltal, hogy csökkenti a nyomást és a növekvő hőmérséklet az egyensúlyi balra tolódik. A mértéke a víz disszociációs termodinamikailag (%) 100 kPa: 0034 (1015 ° C) 0,74 (1711 ° C) 8,6 (2215 ° C), és 11,1 (2483 ° C). Az UV sugárzás hatására, fogyási a víz ionokra H + és OH -. Ionizáló sugárzás hatására a víz radiolízise alkotnak H2. H2 O2 és szabad gyökök; sugárzás. hozam - szétesett mintegy 4 molekula per 1,6 * 10 -17 J. elnyelt sugárzási energia.
Víz - reaktív vegyület. Ez oxidáljuk atomos oxigén: H 2O + O -> H 2O 2. Amikor vízzel reagálva kialakult F2 HF, valamint O, O2. O3. H2 O2. F2 O és mtsai. Csatlakozások. Más halogének alacsony hőmérsékleten, ez a vízzel reagálva egy keveréket képzünk, NNalO HHal savat. Szokásos körülmények között végzett interakció a vizet, amíg abban oldott fele Cl2 és jelentősen kisebb száma Br2 és 12. Ha a megerősített. klór- és bróm hőmérséklet szétesik víz és HHal O2. Átadásával a vízgőz át forró szenet bomlik, és ez létrehozott egy úgynevezett víz-gáz: H2 O + C CO + H2. Amikor magasabb. hőmérséklet és a katalizátor jelenlétében víz reagál CO, CH4 és egyéb szénhidrogének, mint például: H2 O + CO H2 + CO2 (Fe-katalizátor). CH4 + H2O CO + ZN2 (Ni katalizátor vagy Co). Ezeket a reakciókat alkalmazunk a prom. termelő H2. Ígéretes annak előállítására és módszereket termokémiai víz bontása (lásd. Hidrogén Hidrogén Energetikai). Foszfor hevítve nyomás alatt víz jelenlétében egy katalizátor oxidálja metafoszforsav-: 6N2 O + RR -> 5H2 + 2NRO3. Víz interakció sok fémekkel H2, és a megfelelő hidroxidot. Alkáli- és schel.-földet. fémek (kivéve a Mg), ez a reakció még szobahőmérsékleten is. Kevesebb aktív fémek vízzel elbontjuk emelt. hőmérsékleten, például Zn-Mg és 100 ° C felett, Fe - 600 ° C felett (2Fe + O ZN2 -> Fe2 O3 + 3H2). Amikor vízzel reagálva sok oxidok képződött savat vagy bázist. A víz lehet egy katalizátor, mint például alkálifémek és hidrogént klórral jelenlétében csak nyomokban víz alkalmanként víz - katalizátorméreg, mint például a vas katalizátor NH3 szintézis.
Az a képesség, a vízmolekulák alkotnak háromdimenziós hálózat hidrogénkötések lehetővé teszi, hogy az inert gázok, a szénhidrogének, a CO2. Cl2. (CH 2) 2O, CHCI3, és még sokan mások. Anyagok úgynevezett gáz-hidrátok.
A víz, mint oldószer. Víz oldja sok jól poláris és disszociál ionokra anyagokat. Jellemzően, az oldhatóság a hőmérséklettel növekszik, de néha a hőmérsékletfüggését bonyolultabb. Így a oldhatósága számos szulfátok, karbonátok és foszfátok, mint a hőmérséklet növekszik, vagy csökken először növeli, majd egy maximumon megy keresztül. A oldhatósága alacsony polaritású-in (beleértve a gáz tartalmazza a légkörben) vízben alacsony, és ha a hőmérséklet emelkedik általában először csökken, majd ezt követően áthalad a minimális. A növekvő nyomás növeli az oldékonyságot a gázokra nagy nyomás révén maximális. Sok oldott anyagok vízben, reagálnak rá. Például, oldatok NH3 NH4-ionok lehetnek jelen (lásd. Szintén hidrolízis). A víz között, az oldott ionok, atomok, molekulák, hogy nem adja meg a kémiai reakció, és a vízmolekulák vannak nem elpusztítására, és ion-dipólus intermolekuláris. kölcsönhatást (lásd. A hidratáció).
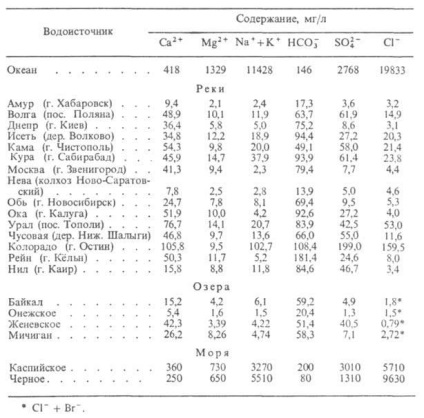
Természetes víz. Ez egy komplex többkomponensű rendszer, amely ásványi anyagok, gázok, valamint a kolloid és a durva szemcsék, beleértve a mikroorganizmusokat. Nagysága a mineralizáció (g / l) megkülönböztetni a következő természetes víz: ultrafresh - legfeljebb 0,2, friss - 0,2-0,5 enyhén sós - 0,5-1,0, enyhén sós - 1-3, sózott - 3- 10, a magasabb. sótartalom - 10-35, átmenet brines - 35-50, brines - 50. macrocomponent több természetes vízben rendszerint Ca, Mg, Na, K, Fe (kationos, vízben), Si, C, S, Cl (anionos víz). Azáltal mikrokomponenseket közé tartoznak a természetes víz és az érc a ritka elemeket, mint a B, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I és mások.
DOS. gázokat természetes víz, - a CO2. N2 (egyaránt jellemző felszíni és mély körülmények között) CH4. CO, H2 (inkább jellemző a földalatti vizek és vulkanich vizet. Aktív régiók). Vízben oldjuk, a komponensek egymással egyensúlyban van, komplexet képezni különböző összetételű. Adatok a készítmény néhány természetes vizet táblázatban mutatjuk be. 2.
Táblázat. 2 ÖSSZETÉTEL természetes vizek
ivóvíz Mikroorganizmusok teljes számának 1 ml ivóvizet nem lehet magasabb, mint 100, a szám a coliform baktériumok (coliform index) - nem több, mint 3. A koncentrációja kémiai anyagok, amelyek megtalálhatók a természetes víz vagy vizet adunk hozzá a feldolgozás során (lásd a víz). nem haladhatja meg a (mg / l):

Üzemi víz. Víz fordított bálba. vállalkozások úgynevezett technikai. Ez elsősorban a hűtőközeg szállítására ömlesztett anyag (például, hydrotransport hamu hőerőművek), oldószert és mások. Általánosságban, az összes iparágak 70-75% -a a teljes áramlás használják hűtőközeg cirkulációs. rendszerbe. Ebben az esetben csak a meleg víz és gyakorlatilag nem szennyezett. A fő szennyezési forrás a hűtővíz keringető rendszer. - víz bekerül a rendszerbe, hogy kompenzálja az elkerülhetetlen veszteségeket, és atm. levegő, a to-poro mossuk vízhűtők szuszpendált szilárd anyagok és gázok, amelyek oldódnak vízben.
Gyógyító víz. A terápiás alkalmazásokban, ami egy természetes vízben, amely jelentős mennyiségű levélfúró, sók, gázok, néhány elem és mások. (Lásd. Az ásványvíz).
Az utóbbi években jelentősen romlott a minősége ivóvíz. Ennek oka az volt jelentős szennyezőanyag-kibocsátás növekedését mind a háztartási, ipari vállalatok termelt. Most a víz kémiai, biológiai, sőt radioaktív szennyeződés, ami rendkívül kedvezőtlen hatással lehetnek az emberi egészségre. Ez megmagyarázhatja a gyorsan növekvő érdeklődés víztisztító rendszerek. mind a vevők és a termelők. Végiggondolva az egészségügyi, egyre több és több ember telepíteni víztisztító rendszerek apartmanok, bungalók, nyaralók.