Nitrogén és vegyületei
Összegzés Ez a tanuló a 11 „és a” Vasev Dmitrij osztály
Nov. középiskolai № 2
Nitrogén (általános információk).
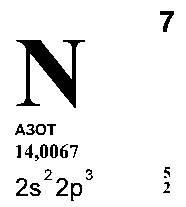
NITROGÉN (lat Nitrogenium -. Gendereth nitrát), N (olvasni "en") - kémiai elem egy második időszakban VA a periódusos rendszer, az atomi száma 7 atomtömegű 14,0067. A szabad állapotban - gáz nélkül színe, szaga és íze, rosszul oldódik vízben. Ez áll a kétatomos molekula N2, amelynek nagy szilárdságú. Arra utal, hogy a nem-fémek.
nitrogénvegyületek
NITRATES - sók salétromsav HNO3, jó szilárd, vízben oldható anyag. Hagyományos orosz neve néhány nitrátok az alkáli- és alkáliföldfém-és ammónium-sói - ammónium-nitrát (ammónium-nitrát NH4NO3, KNO3 kálium-nitrát, kalcium-nitrát Ca (NO3) 2 és mások.
Nitrid - nitrogén kémiai vegyület több elektropozitív elemekkel. Alumínium-, bór, szilícium, volfrám, titán (AlN, BN, Si3N4, W2N, TiN), és még sokan mások - tűzálló, vegyszerálló kristályos anyag. Components szuperötvöze használják félvezető eszközök (pl. Félvezető lézerek, fénykibocsátó diódák) a csiszolóanyagok. Az akció a nitrogén vagy ammónia fémek 500-600 ° C-on olvad nitrid bevonat (nagy keménységű, kopás és korrózió).
Nitrogén-oxidok: a nitrogén-monoxidot N2O és NO (színtelen gázokat) szeszkvioxid N2O3 (kék folyadék)-dioxid NO2 (barna gáz, normál körülmények között, a keverék NO2 és annak dimer N2O4), N2O5-oxid (színtelen kristályos anyag). N2O és NO - nesoleobrazuyuschie oxidok, N2O3 vízzel ad salétromossavval, N2O5 - salétromsav, NO2 - ezek keveréke. Minden fiziológiailag aktív nitrogén-oxidok. N2O - eszközt érzéstelenítés ( „kéjgáz»), NO és NO2 - intermedierek a termelés a salétromsav, NO2 - oxidáló szerrel folyékony hajtóanyagban, robbanóképes keverékeket, nitrálószerrel.
Felmerült a vízkezelésben, kerozinnal vagy bizonyos ásványi olajok; cukorgyárak; a bőr cserzés A beltéri levegő, ahol állatállomány; kloáka része a gáz (együtt hidrogén-szulfid); tartalmazott a nyers acetilén.
Előállításához használt salétromsav, ammónium-nitrát és ammónium-szulfát, folyékony műtrágyák (ammiakatov), karbamid, szóda, a szerves szintézis, a festés szövet blueprinting (a diazónium papír) mint hűtőközeg a hűtőszekrények, a ezüstözött tükör.
Ezt úgy kapjuk közvetlen szintézissel, hidrogént és nitrogént nyomáson 280-350 atm, és általában 450-500 ° (katalizátorok). Kisebb mennyiségben kapott kokszszénhez desztillációval mésszel „ammónia víz” (az első frakciót desztilláljuk száraz szén).
Fizikai és kémiai tulajdonságok. Színtelen gáz egy fojtó szúrós szagú (küszöbérték észlelés 0,037 mg / l) és a lúg ízét. T. op. -77,75 °; t. bálák. -33,35 °; hús. 0,771 g / l (0 °), 0,59 g / l (25 °). Sol. vízben körülbelül 750 g / l vagy 526 g / l; együttható. sol. víz 762,6. Oldódik éterben és más szerves oldószerek. Korlátai robbanásveszélyes koncentrációjának a 15- 28% levegő, oxigén 13,5--79% és 2,2-72% dinitrogén-oxid. A NH3 a levegő gyorsan mozog (NH 4) 2CO3 vagy abszorbeált nedvességet. Stabil a szokásos hőmérsékleten. Nagyon reakcióképes, reagál addíció, szubsztitúció és az oxidáció. A vizes oldat lúgos képződése miatt az ammónium-hidroxid NH * H. A kereskedelmi forgalomban kapható, mint tartalmazó vizes oldatok 28-29% (térf.), NH3, 10% -os NH3 (ammónia) vagy cseppfolyósított NH3 acél palackokhoz.
Előállítása során felhasznált szerves festékek; az élelmiszeriparban; passziváláshoz acéltermékek; gumi és textiliparban, a galvanizáló.
Soda nyert oldat abszorpciója nitrózus gázok salétromsav előállítására és tisztítására, bepárlással és kristályosítással a kapott oo ón-nitritet és nátrium-nitrátot.
Fizikai és kémiai tulajdonságok. Színtelen vagy sárgás kristályok. T. op. 271 °; hús. 2.17: felett 320 ° december elérése előtt a forráspont; sol. vízben 81,8 g / g SO (20 °). 163 g / g SO * Körülbelül „).
Mérgező hatása. Ez vazodilatációt okoz miatt paresis edényben - a motor központ (magasabb dózisok - miatt, és közvetlen hatás a vérerekben), valamint a kialakulását methemoglobin a vérben.
Ez gyártásához használt bizonyos szerves azo-vegyületek n.
Kiderült helyreállítás KNO2 olvadt ólom; SO2 átengedve fűtött keveréke KNO3 és CaO.
Fizikai és kémiai tulajdonságok. Színtelen vagy sárgás kristályok elfolyósodó. T. op. 387 °; hús. 1915; sol. vízben 280 g / 100 g (0 °); 413 g / 100 g (100 °).
A toxikus hatás látszólag hasonló a hatása a NaNO 2.
(Nátrium-nitrát, chilei-nitrát)
Ezt használják a műtrágya; élelmiszer, üveg, fém ipar; a robbanóanyagok, hajtóanyagok és pirotechnikai keverékei.
Ez nyert természetes üledékek kimosódás forró vízzel és kristályosított; felszívódását a nitrogén-oxidok szóda oldatot; cseréje bomlása a kalcium-ammónium-nitrát vagy szulfát, klorid vagy nátrium-karbonát.
Fizikai és kémiai tulajdonságok. Színtelen kristályok. T. op. 309,5 °; hús. 2257; december 380 ° nitritté és oxigén; sol. vízben 88 g / 100 g (20 °), 176 g / 100 g (100 °).
Trágyaként, valamint a termelés hajtóanyagok pirotechnika, az élelmiszeripar és az üvegipar. Kiderült konverziós NaNO3 és KCl át 80-122 ° C-on
Fizikai és kémiai tulajdonságok. Színtelen kristályok. T. op. 334 °; hús. 2,11; december a fenti 338 ° n át nitrit oxigénatom; sol. vízben 31,5 g / 100 g (20 °), 245 g / 100 g (100 °).
(Kalcium-nitrát, nitrát norvég)
Ezt alkalmazzák, mint a műtrágya.
Úgy kapjuk alapján salétromos gázok és a nitrogén-termelés.
Fizikai és kémiai tulajdonságok. T. plail. 561 °; december 500 °; tutajt. 2,36; növekszik, a 126 g víz / g SO (20 °), 363 g / g SO (100 °). A vízmentes só és ennek kristályos hidrátjai nagyon higroszkópos.
Mérgező hatása. Csak az számít, irritálja és cauterizing hatása a nyers terméket, amely kifejezett bőrpír, viszketés, fekély, néha mély és elfoglalja nagy felületen, amelyek lassan gyógyulnak, és hagyjuk tovább hegek. Az érintett területek a bőr, ahol van legalább kisebb sebek, karcolások és egyéb megsértése területi integritását.
A sűrűsége nitrogéngáz át 0 ° C-on 1,25046 g / dm3 a folyékony nitrogén (a forráspont hőmérsékletén) - 0,808 kg / dm3. A nitrogén-gáz normál nyomáson hőmérsékleten -195,8 ° C lesz, színtelen folyadék, és hőmérsékleten -210,0 ° C - egy fehér szilárd anyagot kapunk. A szilárd állapotban formájában létezik két polimorf módosulat: alább -237,54 ° C hőmérsékleten, így stabil köbös rács, a fenti - hatszögletű.
A kritikus hőmérséklet nitrogén -146,95 ° C, kritikus nyomás 3,9MPa, a hármas pont hőmérsékleten -210,0 ° C és nyomása 125,03 hPa, ami azt jelenti, hogy a nitrogén szobahőmérsékleten bármely, még a nagyon magas nyomás nem lehet alakítani egy folyadék.
A hő párologtatás folyékony nitrogén 199,3 kJ / kg (a forráspont hőmérsékletén), a fúziós hőt nitrogén 25,5 kJ / kg (hőmérsékleten -210 ° C-on).
A kötési energiája atom a molekula nagyon magas, és N2 jelentése 941,6 kJ / mól. A központjai közötti távolság a tartalmaznak a molekulában 0,110 nm. Ez azt sugallja, hogy a kapcsolat a nitrogénatomok a hármas. Nagy szilárdságú N2 molekula lehet magyarázni szempontjából a molekulapálya módszerrel. Energia diagram kitöltésével molekulapályák a molekulában N2 azt jelzi, hogy az elektronok töltünk a kapszulába csak kötő s- és p-pályák. Molekula nitrogén nem mágneses (diamágneses).
Mivel a nagy szilárdságú N2protsessy molekula bomlása különböző nitrogén-vegyületek (beleértve a hírhedt robbanásveszélyes RDX) hevítve, fúj, stb .. G. képződéséhez vezet N2 molekulák. Mivel a kötet a termék gáz lényegesen nagyobb, mint a mennyisége a kezdeti robbanásszerű robbanás csörgők.
Kémiailag inertek és inkább a nitrogén szobahőmérsékleten csak lép reakcióba a lítium fém, hogy egy szilárd lítium-nitrid Li3N (3LI + N = Li3N-3).
A vegyületek különböző mértékű oxidáció (-3 +5). Mivel a hidrogén-formák ammónia NH3. (3H + N = NH3) közvetett módon (nem egy egyszerű anyag) kapunk hidrazin N2H4 és hidrazinsav HN3. A sók ezen sav - azidok. Ólomazid Pb (N3) 2 bomlik becsapódáskor, így annak használata, mint egy detonátort, például, kapszula patronok.
Számos nitrogén-oxidok. Halogénekkel nitrogén közvetlenül nem reagál közvetett úton kapott NF3, NCl3, NBr3 és Ni3, valamint több oxi-halogenidek (vegyületek a készítményben, amely mellett a nitrogénatomot, és magában foglalja a halogénatom és az oxigén, például NOF3).
Nitrogén-halogenidek nem stabilak, és könnyen bomlanak melegítés (néhány - a tárolás során), hogy az egyszerű anyagok. Így, Ni3 folyamán kicsapódik elvezetését vizes ammónia oldatok és jód tinktúra. Már egy könnyű rázza száraz Ni3 felrobban:
Nitrogén nem reagál kén, szén, foszfor, szilícium és néhány más nemfém.
Amikor fűtött, a nitrogén reakcióba lép a magnézium-és alkáliföldfém, ahol a saltlike nitridek, amelynek általános képlete M3N2 (3M + N2 = M3N2), amelyeket vízzel elbontjuk, hogy kialakítsuk a megfelelő hidroxid és ammónia, például:
Sa3N2 + 6H2O = 3ca (OH) 2 + 2 N + 3H3.
Hasonlóan viselkednek és nitridek alkálifémek. A kölcsönhatás a nitrogén átmeneti fémek képződéséhez vezet a szilárd fém-nitridek különböző összetételű. Például, ha a vasat és a nitrogén reakciójával vas-nitrid készítmény képződik Fe2N és Fe4N (N2 + 6Fe = Fe2N + Fe4N). Hevítve nitrogén acetilén C2H2 nyerhető hidrogén-cianid HCN (N2 + C2H2 = 2HCN).
A legnagyobb érték a komplex szervetlen nitrogén-vegyületek salétromsav HNO3, nitrátok sói, és a salétromossav HNO2 és sói nitritet.
Az iparban a nitrogén nyert levegőt. Ennek az első hűtött levegő cseppfolyósított és a folyékony levegő desztilláljuk (desztilláció). A forráspont nitrogén valamivel alacsonyabb (-195,8 ° C), a levegőtől eltérő komponensek - oxigén (-182,9 ° C), ezért az első nitrogén bepároljuk enyhe melegítés cseppfolyós levegő. A fogyasztók a nitrogén gázt egy tömörített formában (150 atm., Vagy 15 MPa) fekete hengerek, sárga felirattal „nitrogén”. Folyékony nitrogénben tároltuk Dewar edények.
A laboratóriumban tiszta ( „kémiai”) úgy állítjuk elő, nitrogén hozzáadásával hevítve NH4CI telített ammónium-klorid oldatot, hogy a szilárd nátrium-nitritet NaNO 2:
NaNO 2 + NH4CI = nátrium-klorid + N2 + 2H2O.
Az is lehetséges, hogy a hő a szilárd ammónium-nitrit:
NH4NO2 = N2 + 2H2O.
Az iparban, a nitrogén gáz elsősorban a termelés az ammónia. Mint egy kémiailag inert gáz, nitrogént használunk, hogy egy semleges környezetben a különböző kémiai és metallurgiai folyamatok, ha a pumpáló gyúlékony folyadékok. A folyékony nitrogént széles körben használják, mint egy hűtőközeg, ez primenyayui a gyógyászatban, különösen a kozmetika. Fontos a talaj termékenységének fenntartásában nitrogén műtrágyák.
Fedezte fel 1772-ben a skót tudós Rutherford D. álló szén égéstermékek a kén és a foszfor, mint a gáz, alkalmatlan a légzés és az égés ( „fulladás a levegő”), és ellentétben CO2ne felszívódó alkáli-oldatban. Nem sokkal később a francia kémikus AL Lavoisier következtetésre jutott, hogy „fojtogató” a gáz belép a levegőbe, és azt javasolta neki a nevét „nitrogénbôl” (a görög azoos -. Élettelen). 1784-ben az angol fizikus és kémikus H. Cavendish létrehozta jelenlétében nitrogén-nitrát (innen a latin neve a nitrogén, javasolt 1790-ben a francia kémikus Chantal J.).
Irodalom
„A mérgezés hatása a nitrogén-vegyületek az emberi szervezetben.” (Www.google.ru dokumentumot a gyorsítótárból).
„Előállítása és alkalmazása a nitrogén és vegyületei.” (Www.google.ru dokumentumot a gyorsítótárból).