A forráspontja a víz-alkohol elegyek
Természetesen a két anyagot forrásban lévő oldatához - víz (forráspont = 100 ° C-on 760mm.rt.st) és etanol (forráspont = 78,3 ° C-on 760mm.rt.st) között kell elhelyezni a forráspontja az egyes anyagok. A függőség a hőmérsékleten telített vizes gőz vagy alkohol forráspontja közötti hőmérsékleten (párologtatás) a kétkomponensű keverékben az alkohol koncentrációjának az Y pár az 1. ábrán látható.
Érdemes megjegyezni, hogy ez a grafikon, van egy pont a koncentrációban a 96,4%, ahol a hőmérséklet még kevesebb, mint a forráspontja 100% -os etanolt.
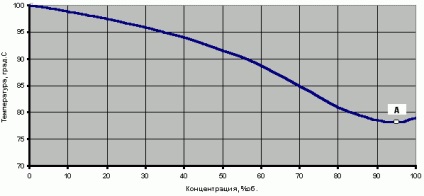
1. ábra a hőmérséklet hidroalkoholos telített gőz vagy forró víz hőmérséklete-alkohol keverék (760 Hgmm)
Fázis egyensúlyi állapotban (folyadék és gőz) olyan együttélés, ahol nincs látható minőségi vagy mennyiségi változásokat e fázisokat. Egyensúlyi elérte fázis a csak, ha két feltétel teljesül egyidejűleg: a hőmérséklet és a fázisokat egyenlő parciális nyomás az egyes komponensek a gőz és folyadék fázis. A második feltétel azt jelenti, hogy az átmenet a határfelületen át a fázis az egyes komponensek a folyékony fázistól, hogy a gőzfázisban, és vissza befejeződött. Ie a folyékony és gőz készítmények stabilizált, és azt a koncentrációt komponensek egyetlen fázisban, azonos minden ponton a térfogatának.
Bináris víz-alkohol keverék elméleti tétel egy nagyon egyszerű dolog. Ha egy szokásos lombikba (vázlatosan rajzolt a grafikon a 2. ábrát), hogy öntsünk egy kis mennyiségű víz-alkohol keverék a koncentráció Xzh melegítjük és a forráspontja a keverék, a pár a képződött alkohol koncentráció lesz Yn. Ezután, ha a közeli gyorsan lombikot és erőteljesen rázzuk (keverjük gőz és folyékony fázisban), a hőmérséklet a kúp kiegyenlített, és a gőz és a folyadék egyensúlyának beállásához - a koncentrációk azok az Y és X, illetve az alkohol.
Ha az ilyen kísérleteket végeztünk különböző koncentrációinak a víz-alkohol oldatok, akkor lehetséges egy bizonyos függését egyensúlyi fázis - a fázis egyensúlyi görbéje. egyensúlyi görbéje grafikon a bináris fázisként tiszta alkohol + tiszta vizet a 2. ábra mutatja.
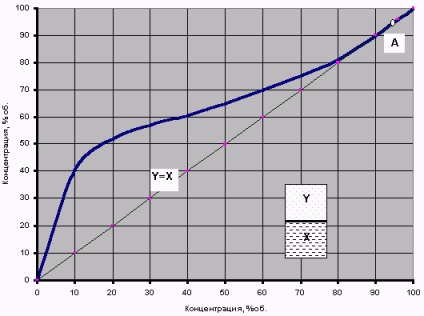
2. ábra egyensúlyi görbéje a biner elegyet víz-alkohol fázis
(760 Hgmm nyomáson)
Elméleti és gyakorlati jelentősége a fázis egyensúlyi görbéje szempontjából a desztillációs eljárásban az alkohol nagyon magas, de vissza fogunk térni erre később a „kijavítása” rész, és most azt mutatják, hogyan kell használni ezt a görbét.
Például, a hagyományos desztillációs a cefre egy alkohol koncentráció X = 10% gőz keletkezik koncentrációban = 42% spirtaY ott, és után kondenzáció, megkapjuk „főzet” (kondenzátum desztillátum) Same „vár”. Így, ha a holdfény nem rendelkezik, amit néhány további „harangok és a síp”, kapsz egy erősebb sört ily módon elvileg lehetetlen. Ugyanígy lehet „megjósolni” az azonos görbe és eredményt újradesztillálása „Pervatsch” - 40% a desztillátum oldatának a második desztillációs lehet beszerezni egy 60% „főzet”.
Néztem ezt a grafikont, akkor kell figyelni az átlós Y = X Annak a ténynek köszönhetően, hogy szinte az összes egyensúlyi görbéje fölött fekszik ez a diagonális lehet a víz elpárolgását és alkohol keveréke, így az alkohol koncentráció a gőz nagyobb a koncentrációja a forrás folyadék. Az egyetlen kivétel az A pont - egyensúlyi görbéje keresztezi az átlós, ahol X = Y = 96,4%. Ez szinguláris pont azeotrópot.
Forráspont azeotrop vagy elválaszthatatlanul nevezett keverék, amelyben a gőz egyensúlyban van a folyadék összetétele ugyanaz, mint a folyékony keverék (X = Y). A desztillációs azeotrop keverékeinek kondenzációs ugyanolyan összetételű, mint a kiindulási keverékben. Az elválasztás ilyen keverékek desztillációval és helyesbítés kizárt.
Víz-alkohol elegy egy szinguláris pont azeotropot úgynevezett „finomított etil-alkohol (CP).” Ez erre a pontra irányul kiigazítási eljárás, hogy ez korlátozó alkohol koncentrációja ebben a folyamatban, és ezen a ponton a víz-alkohol elegy van egy minimális forráspontú (fp = 78,15 ° C 760mm.rt.st. Cm. Ábra. 1).