Aromaticitás kritériumok aromatikusságának, Hückel szabályt az aromás, benzoid és példák
Gyűrűs konjugált rendszerek a nagy érdeklődés, mint egy csoport vegyületek fokozott termodinamikai stabilitással rendelkeznek, összehasonlítva párosított nyílt rendszerek. Ezek a vegyületek más specifikus tulajdonságokkal, amelyek együttesen egyesítjük általános fogalma aromatikusságának. Ezek közé tartozik a képességét formálisan telítetlen vegyületek lép egy szubsztitúciós reakciót, csatlakoztatás helyett a fellépés a oxidánsok és hőállóság.
Tipikus képviselői ezeknek az aromás rendszerek az aréna és származékaik. Jellemzői az elektronikus szerkezet az aromás szénhidrogének egyértelműen nyilvánul meg atomi modelljét a benzol molekula. benzol csontváz formában hat -gibridizovannyh sp2 szénatomot tartalmaz. minden # 963; -bond (C-C és a C-H) egy síkban fekszik. Hat nem-hibridizált p-AO molekulák vannak elrendezve síkjára merőleges, és egymással párhuzamosan (3A.). Minden p AOS ugyanígy átfedésben a két szomszédos p AOS. Ennek eredményeként az átfedés van egy egyetlen delokalizált π-rendszer, a legnagyobb elektronsűrűségű, amely alatt és felett a sík # 963; -skeleta ciklusban, és magában foglalja az összes szénatom (lásd a 3b ábrát ..). π-elektron sűrűség egyenletesen oszlik el a gyűrűrendszer, amint az a fantom kör vagy egy hurkot (lásd. ábra. 3c). Minden közötti kötések szénatomot tartalmaznak a benzolgyűrű egyforma hosszúak (0,139 nm), közbenső hosszai közötti egyszeres és kettős kötések.
Alapján a kvantummechanikai számítások megállapításra kerül, hogy a kialakulását ezek a stabil molekulák lapos gyűrű rendszert kell tartalmaznia (4n + 2) π-elektronok, ahol n = 1, 2, 3 ,. D. (Hückel szabály. 1931). A koncepció a „aromásság” megadhatja fényében ezeket az adatokat.
Aromás rendszerek (molekulák) - rendszerek, amelyek megfelelnek a kritériumoknak aromatikusságának:
1) jelenléte lapos # 963; -skeleta álló SP 2 -gibridizovannyh alkilcsoport;
2) delokalizációja elektronok képződéséhez vezet egyetlen π-elektron felhő-CIÓ, amely kiterjed az összes atom a ciklus (ok);
3) E. Hückel szabály megfelelő, azaz a teljes elektron felhő kell 4n + 2 π-elektront, ahol n = 1,2,3,4 ... (jellemzően szám azt jelzi, a ciklusok száma a molekulában);
4) nagyfokú termodinamikai stabilitása (a nagy energiájú csatolás).
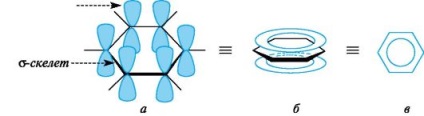
Ábra. 3. Atomic orbitális modell benzol molekula (hidrogénatomok elhagyjuk, a magyarázat a szövegben)
Stabilitás konjugált rendszereket. A formáció a konjugátum, és különösen aromás rendszer - energetikailag kedvező folyamat, mert ez növeli a átfedési foka pályák delokalizált és (diszperziós) p-elektronok. Ebben a tekintetben, konjugált vagy aromás rendszer megnövekedett termodinamikai stabilitást. Ezek tartalmaznak egy kisebb tartalékot a belső energia az alapállapotú és elfoglalják energiatartalma alacsonyabb, mint a nem-konjugált rendszerek. A különbség ezek a szintek lehet mennyiségileg termodinamikai stabilitást a konjugált vegyület, m. E. A kapcsolási energia (energia delokalizáció). Ahhoz, hogy az 1,3-butadién kicsi, és ez körülbelül 15 kJ / mól. A növekvő hossza a konjugált lánc, és ennek megfelelően az energia a párosítás termodinamikai stabilitásának a vegyületek növekszik. Energia a konjugáció benzol sokkal, és 150 kJ / mól.
Példák nebenzoidnyh aromások:
Piridint elektron szerkezete hasonlít a benzol. Valamennyi szénatom és a nitrogénatom vannak sp 2 hibridizációs és az összes # 963; -bond (C-C, C-N és C-H) fekszenek ugyanabban a síkban (4a ábra.). A három hibrid pályák a két nitrogénatom részt vesz a kialakulását
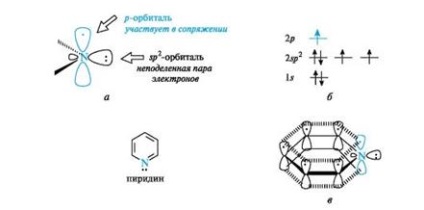
Ábra. 4. A piridint nitrogénatom (ok), a az elektronok eloszlását pályák (b) és a konjugált rendszer a molekulában piridin (a) (a C-H elhagytuk a rajz egyszerűsítése)
# 963; -kötéseken szénatomjaihoz (csak a tengely ezen pályák), és a harmadik tartalmazza a magányos pár orbitális elektronok a kötés kialakulása nem vesz részt. azzal a nitrogénatommal elektronszerkezet említett piridin.
Mivel az elektron található a nem hibridizálódott p pályák (lásd. Ábra. 4b), a nitrogénatom részt vesz a kialakulását egyetlen elektron felhő elektron vö öt szénatomot tartalmaz (lásd. Ábra. 4c). Így, piridin π, π-konjugált rendszer és a kritériumokat az aromás.
Ennek eredményeként, egy nagyobb elektronegativitási képest a szénatom a piridin nitrogénatomjának csökkenti az elektronsűrűség a szénatomok az aromás gyűrű, így egy olyan rendszert, egy piridin nitrogénatomja úgynevezett π-deficiens. Emellett a piridin, egy példa az ilyen rendszerek pirimidin, piridin, amely két nitrogénatomot tartalmaz.
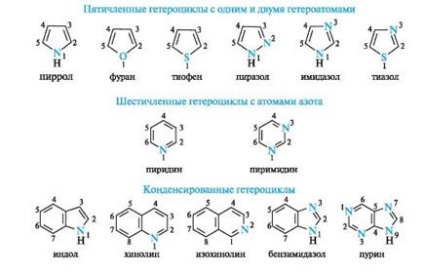
Pirrol is utal, hogy az aromás vegyületek. szénatommal és a nitrogénatommal abban, például piridinben, egy állami sp2-hibridizáció. Azonban, ellentétben a piridin nitrogénatom a pirrol egy másik elektron konfiguráció (5a., B).
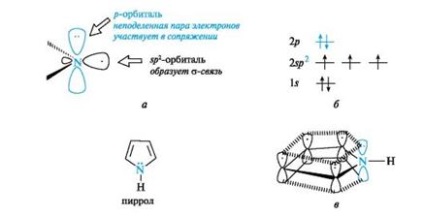
Ábra. 5. pirrol nitrogénatom (ok), a eloszlása elektron pályák (b) és a konjugált rendszer a molekulában pirrol (c) (C-H kötések vannak hagyva, hogy a rajz egyszerűsítése)
A nem hibridizált p atomi nitrogén osztatlan elektronpárt. Részt konjugációval p -elektrona- km négy szénatomot tartalmazó, így egységes felhő shestielektronnogo (lásd. Ábra. 5c). A három sp 2 pálya formájában három -Hybrid # 963; -bond - két szénatomot, az egyik hidrogénatom. A nitrogénatom ebben az elektronikus állapotban úgynevezett pirrol.
Shestielektronnoe felhő pirrol miatt p, n-konjugát delokalizált öt gyűrűatomot, így pirrol jelentése π-redundáns rendszert.
A furán és tiofén aromás szextett tartalmaz egy osztatlan elektronpárt hibridizálatlan p-AO oxigén- vagy kénatom, illetőleg. Az imidazol és a pirazol két nitrogénatommal hogy a különböző hozzájárulások a delokalizált elektron felhő: pirrol nitrogénatomján szállít pár π-elektronok, és a piridin - az egyik p-elektron.
Is rendelkezik aromásság purin képviselő rendszer két kondenzált heterociklusok - pirimidin és imidazol.
Delokalizált elektron felhő a purin magában foglalja a 8 π-elektronok a kettős kötést, a magányos elektronpár, az atom N = 9. A teljes elektronok száma konjugáció egyenlő tíz megfelel a képletnek, Hückel (4n + 2, ahol n = 2).
Heterociklusos aromás vegyületek rendelkeznek nagy termodinamikai stabilitást. Nem csoda, hogy ezek a szerkezeti egységek legfontosabb biopolimerek - nukleinsavak.