receptor tirozin-kinázok
A család a monomer receptorok
Ilyen közel a Pu Pu kemokinek és segíthet a vírus menekülni a hatását a gazdaszervezet immunrendszere miatt molekuláris mimikri fehérjék részt vesznek a végrehajtása a biztonsági funkciókat. Py által kódolt herpesz vírussal összefüggő Kaposi-szarkóma, konstitutív hatással rendelkezik elleni Gq, amely különösen vezet történő kifejeződésének indukcióját a vaszkuláris endoteliális növekedési faktor és az angiogenezist a daganatban.
A receptor tirozin-kinázok vannak osztva két család, eltérő a struktúrája a szervezet.
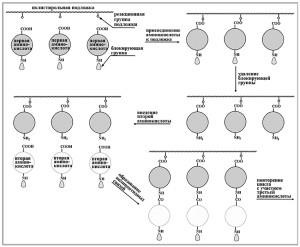
Levezetése jel monomer tirozin-kinázok
Megkötő ligandumok Pij, Ig-tartalmú szerkezettel lehet szabályozni proteoglikánok.
Egy tipikus kiviteli alaknál a ligandumkötő okok dimerizációs Py-TION, kíséretében reciprok foszforilációja intracelluláris EK domén dimer. Ez legalább két következménye van: 1) növekvő enzimatikus aktivitását a kináz domént és 2) létrehozása kötőhelyeket fehérjék, amelyek felismerik a rövid aminosav-motívumok tartalmazó fosfotirozil. A funkció a felismerési által végzett speciális területeken a fehérjék, a leggyakoribb, amely az SH2 domén (2. domén homológ intracelluláris tirozin-kináz src), amely körülbelül 100 AA maradványok. Kötődik a foszforilált fehérjék válhat Py szubsztrátjai, azaz alávetni foszforiláció. Ha ez a fehérje kapcsolódik a RC ez egy olyan enzim, foszforiláció változásokat (növekszik) az enzimatikus aktivitását. Ha az adapter asszociált fehérje, annak foszforiláció olyan közvetett kölcsönhatás Pij harmadik fehérjét értünk, amely akár a foszforiláció Py vagy megváltoztatásával konformációját a kötődés hatására megváltoztathatja annak aktivitását. Kötődése Py és enzimet, és az adapter fehérjék vezet a változást a sejten belüli elhelyezkedés, közelebb a megvalósítás helyét a tevékenységük.
Tug857 autofoszforilezés van beállítva, hogy fokozza az enzimaktivitást Pij. A Py foszforilezett helyén specifikusan kölcsönhatásba lép számos 8N2-tartalmú proteinek - a foszfolipáz C-y (PLC-y), a szabályozó CE (p85) Z'-foszfatidilinozitol-kináz (RІZK); fehérje GAP, GTPáz aktiváló Ras; 3 Src tirozin kináz család tagja (pp60c-src, p59fyn, pp62c-igen), egy protein tirozin foszfatáz-2 (SHP-2).
receptor molekulához
SH2 domének a konszenzus felismert szekvencia Y (P) XNX. Számos más fehérjék (adapterek) tartalmazó SH2 domének, (például, a transzformáló fehérjét, amely egy domén homológ 2 Src, Ő), kötődni tud több helyszínen foszforilezett Py, azaz viszonylag aspecifikusan [Ő tartalmaz egy másik kideríteni foszfotirozin tartalmazó konszenzus szekvencia NPXY (P) domént, PTB]. Néhány SB-, amelyek tartalmazzák a fehérjék közé tartozik még egy homológ régiót (SH3), szintén részt vesz a fehérje-fehérje kölcsönhatások (SH3 felismeri prolin motívumot tartalmazó). Ez lehetővé teszi, hogy az adapter fehérjék teljesítenek áthidaló funkció közötti Pij illetve a hozzá tartozó fehérjék és a mögöttes elemei a jel rendszer. Például, fehérje 2 kötő növekedési faktor FIJ (Grb2), közvetlenül kommunikálhat Py vagy Pu társított CE p85 PI3K, SHP-2 vagy ő, a Grb2 sőt domének vesznek részt az ezeket a kölcsönhatásokat, változhat. Az alábbiakban a domain szervezet egyes adapter fehérjék.
Vegye figyelembe, hogy receptor molekula nem egyenlő kölcsönhatásba egyidejűleg az összes enzimes és ADAP-Thorn-fehérjék, amelyek affinitást mutatnak a Py. Így kötődés Pu PLCy vagy Ras-GAP PDGFRp csökkenti a képességét, hogy aktiválja a PI3K. Adapter fehérjék vesznek részt nemcsak hordozó jel adatokat Pij, de kapcsolódnak a jeleket a különböző típusú rendszer Pij. Például, az adapter fehérjét Nck2 (nem-katalitikus régiója tirozin kináz - egy fehérje, amely a nem-katalitikus régiót tirozin-kináz) reagáltatjuk egyidejűleg a receptor tirozin-kinázok és más adaptor protein - csipet (különösen érdekes új Cys-His fehérje) - «különösen érdekes új Cys-His fehérje „), amely viszont komplexet képez a protein kináz kötött integrineket ILK (integrin-kapcsolt protein-kináz), bevont hordozó jellé Py sejtadhéziót integrinek.
enzimfunkciót
BECSÍPŐDHET is kölcsönhatásba lép fehérjékkel DOCK csoport (ajánló szerző citokinézis fehérje - szánt citokinek), amelyek a sejt felületi változások a tapadást. Py-tirozin-kinázok kölcsönhatásba léphetnek fehérjékkel DOCK csoport és közvetlenebb módon - adapteren keresztül fehérjék Nek és Crk (SH3 domének vesznek részt kötődését adapterek DOCK). Így, adapter fehérjék komplexet alkotnak hálózatot kölcsönhatások különböző jelátviteli rendszerek.
A következő a funkciók enzimek társított aktivált PDGFRp \ Ras-GAP (fehérje 1, GTPáz aktiváló Ras) együtt az SH2 domének tartalmazhat több más funkcionális domént - SH3, plekstrinom homológia dómén (PH); domén kalcium-függő lipid-kötő (C2); aktiváló domén, GTPáz aktivitását Ras (Ras-GAP).
Ellentétben a neve, nem aktiválja a GAP, és gátolja a Ras gyorsításával hidrolízisével kötött GTP Ras (azaz GAP aktiválja a GTPáz aktivitását Ras) bevonásával a C-terminális domén GAP. Ezáltal toborzó GAP Rts foszforilezett tirozin-kináz gátlásához vezet jeltovábbítási útvonal Ras - »MARK. Mutációk a domain SH2 GAP, amellyel a fehérje kölcsönhatásba lép az RC, vezethet malignus transzformáció sejtek. Amellett, hogy a Ras, GAP kölcsönhatásba léphetnek számos más fehérjék és szabályozzák azok aktivitását. Így, kölcsönhatás GAP endoribonukleáz G3BP befolyásolhatja azt a sebességet a defoszforilációja az utóbbi, és így - az intenzitás a az RNS lebomlását a sejtben. Azt is megállapították, hogy a különbség nem csak a Ras, de a végrehajtó. Egy lehetséges mechanizmus ezen reakcióút a kölcsönhatás SH3 GAP domén kináz domént szerin / treonin kinázok Aurora-csoport, mely gátolja az enzimaktivitást az utóbbi (Aurora kináz csoport részt vesz a befejezése a mitotikus ciklus).
A formáció két második messenger hormonhatású
A PH domén és C2 GAP részt sejtproliferáció gátlására vonatkoznak.
PLCy (foszfolipáz Cy) fontos szerepet játszik számos osztályok jelek Pn, Pn beleértve tirozin-kináz. Képződését katalizálja két másodlagos hírvivők hormonhatású - diacil-glicerinné (DAG) és az inozit-1,4,5-trifoszfát (IP3) hidrolízisével foszfatidil-inozitol-4,5-biszfoszfát.
A katalitikus aktivitását az enzim domének által meghatározott X és Y, ami megnövekedett foszforilációt Py-tirozin-kinázok. Foszforilálják és aktiválják PLCy képes és a nem-receptor tirozin-kináz-csoport, beleértve a Src, aktivált receptor tirozin kinázok. Egyéb enzim tartományok lehetnek részt vesz a fehérje-fehérje kölcsönhatások, amelyek meghatározzák más módon a szignáltranszdukció bevonásával PLCy. Így, azt mutatja, a kötődését SH2 domének PLCy keresztül SH3 és P115 fehérje intracelluláris transzportban játszanak szerepet és egyesíti a plazmamembrán szekréciós vezikulumokban. SH3 domént az enzim egy eddig ismeretlen mechanizmus biztosítja hormonális stimuláció kalcium belépését sejtekbe. Lényeges, hogy ez a stimuláció az enzim aktivitását PLCy nem szükséges. A PH domén, amely képes kölcsönhatásba PLCy foszfatidil-inozitol-3,4,5-trifoszfát (R1-3,4,5-P3) - a termék a katalitikus aktivitását egy másik FIJ kapcsolódó tirozin-kináz enzim - PI3K. Ez a kölcsönhatás serkenti mozgást PLCy a fej területén a migráló sejtek, ahol az enzim állítólag modulálják aktin polimerizáció.
Src - családi citoplazmatikus tirozin-kinázok protoonkogén. N-láncvégmódosított mirisztát, ami biztosítja horgonyzó a plazmamembrán. A legszélesebb körben fejezte src, fyn, igen.