Oxidok és savak Foszfor - tudja, hogyan
Oxidjai és savak foszfor. Foszfor képez három vegyület az oxigénnel: P2 O3 - foszfor-anhidrid, P2 O5 - a foszfor-pentoxid és a foszfor-tetroxiddal P2 O4.
A foszfor-anhidrid P2 O3 nyerik lassú oxidáció foszfor vagy abban az esetben, amikor foszfor elégetik elégtelen hozzáférést az oxigén. Ez egy fehér, kristályos anyag, amelynek olvadáspontja 23,8 °, forráspontja 173 ° C. A molekulatömege az utóbbi alacsony hőmérsékleten a következő képlettel P4 O6. A hideg víz a kereset foszfor-anhidrid lassan ehhez csatlakozó, amely egy foszforossav-H3PO3. Mivel a foszfor-anhidrid és foszforossav erős redukáló tulajdonságokkal.
Foszfor-pentoxid P2 O5 foszfor elégetésével keletkezett a levegő vagy oxigén mint fehér terjedelmes „snowlike tömege, olvadáspontja 563 ° C. A sűrűsége pár képlet P4 O10.
Foszforsavanhidrid mohón, megköti a vizet, és ezért használjuk a jó dehidratálószer. Ez azt is hogy az elemek a víz egyéb vegyületek, mint például a kénsav és salétromsav. A levegő, foszfor-pentoxid, húzza nedvességet gyorsan terjed, fordult egy ragacsos massza metafoszforsav.
Molekuláris szerkezete a foszfor és a foszforsav-anhidrid fejezhető ki az alábbi szerkezeti képletek:
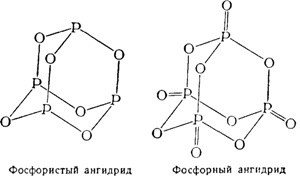
Foszfor-tetroxid O4 P2 jelentése egy fényes, színtelen kristályok alakjában. Ezt az oxidot, mint N2 O4 lehet tekinteni, mint egy vegyes anhidrid. Amikor vízben oldjuk képződött ekvimoláris mennyiségű foszforsav és foszforossav:
Foszforsav. Foszforsav-anhidrid a hőmérséklettől függően lehet csatolni különböző mennyiségű vizet alkotnak egy meta-, piro- és az orto-foszforsav:
Amikor oldott foszfor-pentoxid hideg vízben képződött metafoszforsav-, a legegyszerűbb képlet NRO3; Valójában molekulaszerkezetét kifejezve a képlet (NRO3) x, ahol x = 3, 4, 5, 6, és így tovább. D. Az oldat bepárlásával metafoszforsav izolálunk üvegszerű massza, vízben jól oldódik.
Metafoszforsav-nagyon mérgező. Sók metafosfor-használt sósav a víz lágyítására.
Ha a forrásban lévő oldathoz metafoszforsav, majd bekövetkezik mellékletet hozzá és képződött vízmolekulák hárombázisú ortofoszforsav H3 PO4.
Ortofoszforsav H3 PO4 képez színtelen, átlátszó kristályok, amelynek olvadáspontja 42 °. A vízben nem oldódik jól.
Ortofoszforsav nem mérgező.
Hevitésre ortofoszforsav száraz állapotban 215 ° mindegyikének két hasított molekulákat és egy vízmolekula pedig kapunk négybázisos pirofoszforsav formájában vízoldható üveges tömege:
A három fent említett savak a legfontosabb ortofoszforsav, amelyek általában szem előtt, amikor beszélünk foszforsav.
Foszforsav nyerhető nemcsak forralással metafoszforsav oldat, de az oxidációs vörösfoszfor perc salétromsav:
Ipari célokra főleg ortofoszforsav fellépés kénsav a kalcium-foszfát:
Az így kapott kalcium-szulfát van majdnem oldhatatlan vízben, ezért a foszforsav oldat könnyen elválasztható, és besűrűsödött bepárlással.
A foszforsav közepesen erős sav. Elsődleges disszociációs állandó egyenlő 7,5 • 10 -3. A vizes oldatot, előnyösen foszforsav disszociál ionokra és H • H2 PO4 '
Ahogy a hárombázisú sav, ortofoszforsav képez három sorozatban sók: normál sók, a savas sókat egy hidrogénatom a savas maradékot és savas sók, hogy két hidrogénatom a sav molekularész. Normál a foszforsav sói nevezzük foszfátok, a savas - hidrogénfoszfát.
Minden primer foszfátok vízben oldhatók; A szekunder és tercier foszfátok oldható csak nátrium-, kálium- és ammóniumion.