telített gőz
Ha nyitott edényben maradt víz hosszú ideig, végül a víz elpárolog teljesen. Pontosabban elpárologni. Mi a párolgás és miért történik?
2.7.1 párolgás és kondenzáció
Ezen a hőmérsékleten, a folyékony molekulák különböző sebességgel. Sebesség legtöbb molekula közel esik egy bizonyos átlagértéket (jellemző erre a hőmérséklet). De az egész molekula sebessége jelentősen eltérnek az átlagostól kisebb és b'olshuyu oldalon.
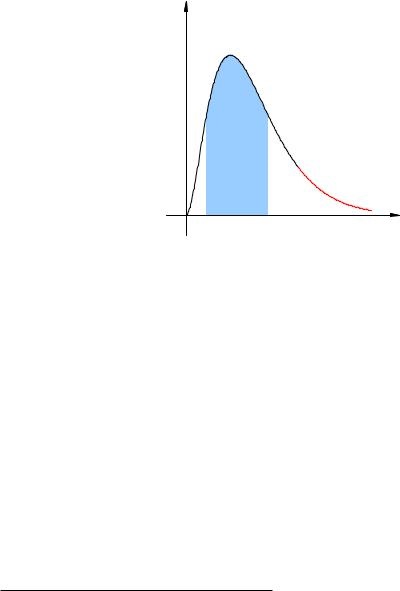
Ábra. 2.16 ábra egy példakénti grafikonja folyadék sebességének eloszlása molekulák. Kék háttér mutatja a nagyon nagy a molekulák, a sebesség csoportosított az átlagos érték körül. Red ¾hvost¿ generált kisszámú ¾bystryh¿ molekulák sebességgel, amely lényegesen meghaladja az átlagos sebessége az ömlesztett folyadék molekuláival.
Ábra. 2.16. Az elosztó a sebesség
Amikor egy ilyen molekula lenne elég gyors a szabad folyadékfelszín (m. E. az interfész a folyadék és a levegő ebben a részben), a kinetikus energia a molekula lehet ahhoz, hogy biztosítsák, hogy leküzdeni a vonzó erők és a más molekulák repülni a folyadékból. Ez a folyamat a bepárlás és a molekulák elhagyta a folyékony formában párokat.
Így, párolgása e folyadék gőzzé átalakítási folyamat előforduló szabad felületén 7.
Előfordulhat, hogy egy idő után a gőz molekula visszatér a folyadék.
Az átmeneti folyamat gőz molekulák a folyadék az úgynevezett kondenzációs. Vapor kondenzációs eljárás reverz folyadék párolog.
2.7.2 Dinamikus egyensúly
És mi lenne, ha egy hajó a folyékony hermetikusan zárt? gőz sűrűség a folyadék felszíne feletti növekedni kezd; gőz részecskék mind erősen zavarja más molekulákkal folyékony kirepülnek, és a párolgási sebesség csökken. Ugyanakkor kezdődik
7 Bizonyos körülmények között a folyadék válik gőz is előfordulhat az egész folyadék térfogatának. Ezt a folyamatot jól ismert meg forr.
növelik a kondenzáció sebességét, mivel a gőz koncentrációját növekvő számú molekulák, visszatér a folyékony, ez lesz egyre több és több.
Végül, egy bizonyos ponton, a kondenzáció sebességét egyenlő lesz a párolgási sebesség. Eljön között dinamikus egyensúly folyadék és gőz: egységnyi idő alatt a folyadék kerül ki az azonos számú molekulát, hogy mennyi van vissza a gőz. Kezdve ebben a pillanatban a folyadék mennyisége megszűnik csökkenti és növeli a gőz mennyiségét; párok eléri ¾nasyscheniya¿.
Telített gőz gőz, amely dinamikus egyensúlyban van a folyékony állapotban. Pr még nem érte el a dinamikus egyensúly állapotában a folyadékkal, az úgynevezett telítetlen.
gőznyomás és sűrűsége jelzi n és n p. Nyilvánvaló, p n, és n értéke egy maximális nyomás és a sűrűség, amely lehet egy gőz egy adott hőmérsékleten. Más szóval, a nyomás és a sűrűsége a telített gőz nyomása mindig meghaladják a sűrűsége a telítetlen gőz.
2.7.3 Tulajdonságok telített gőz
Úgy tűnik, hogy az állam a telített gőz (például a több telítetlen) lehet közelítőleg által leírt állapotegyenlet az ideális gáz (Mengyelejev-Clapeyron egyenlet). Különösen, van egy hozzávetőleges közötti összefüggést telített gőz nyomása és sűrűsége:
Ez egy nagyon meglepő tény is megerősíti kísérletben. Miután az összes, annak tulajdonságait, telített gőz lényegesen eltér az ideális gáz. Felsoroljuk a legfontosabb ezek a különbségek.
1. állandó hőmérsékleten a telített gőz sűrűség független a térfogatának.
Ha például, telített gőz izotermikusan tömöríteni, akkor annak sűrűsége először növelik, a kondenzáció sebességét meghaladja a párolgási sebesség, és a gőz kondenzálódik folyékony előtt, amíg ismét nem fordul elő dinamikus egyensúly, amelyben gőz sűrűség visszatér a korábbi értékre.
Hasonlóképpen, a izotermikus expanzió telített gőz sűrűsége először csökken (gőz válik telítetlen), a párolgási sebesség meghaladja a kondenzáció sebességét és a folyadék tovább pároljuk, amíg ismét nem alakult dinamikus egyensúly m. E. Amíg a gőz ismét telítődik az azonos sűrűség értékét.
2. a telített gőz nyomás független a térfogatának.
Ez abból a tényből következik, hogy a gőz sűrűség nem függ a térfogat és a nyomás egyedileg arányos a sűrűséggel egyenletet (2.6).
Mint látjuk, a törvény Boyle Mariotte, érvényes ideális gázok, telített gőz nem kerül végrehajtásra. Ez nem meglepő, mert származik az egyenlet Mengyelejev-Clapeyron feltételezve, hogy a tömeg a gáz állandó marad.
3. Az állandó térfogatú telített gőz sűrűség növekszik a hőmérséklet emelkedésével és csökken a csökkenő hőmérséklettel.
Valóban, a hőmérséklet növelésével növekszik a párolgási sebesség folyadék. Dinamikus egyensúlyi először megtört, és van egy további
párolgása néhány folyadék. A páros lesz hozzá, amíg a dinamikus egyensúly újra helyreáll.
Hasonlóképpen, a hőmérséklet csökken a párolgás sebessége folyadék kisebb lesz, és a gőz egy része kondenzálódik, hogy amíg a dinamikus egyensúly helyreáll, de kisebb mennyiségű gőzt.
Így izochor fűtési vagy hűtési gőzt megváltoztatja a tömegét, így Charles törvény ebben az esetben nem működik. telített gőznyomás hőmérsékletfüggését már nem egy lineáris függvény.
4. A gőznyomás növekszik a hőmérséklettel gyorsabban lineárisan.
Tény, fokozott hőmérséklet növeli a sűrűsége telített gőz és egyenlet szerint (2.6), a nyomás arányos a termék sűrűségének a hőmérséklettől.
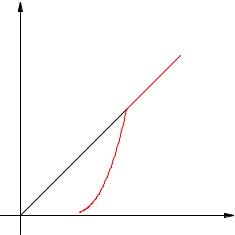
A függőség gőznyomás hőmérséklet exponenciális (ábra. 2.17). Ő képviseli szakasz 1-2 ütemtervet. Ez a kapcsolat nem lehet arra következtetni, ideális gáztörvény.
Ábra. 2.17. A függőség gőznyomás hőmérséklet
2. pontban, az összes folyadék elpárolog; Magasabb hőmérsékleten a gőz válik telítetlen, és nyomás lineárisan növekszik a Charles törvény (tétel 2-3).
Emlékezzünk, hogy az ideális gáz lineáris nyomásnövekedés miatt megnövekedett intenzitású sokk molekulák az edény falához. Abban az esetben, fűtés a gőz molekulák elkezdenek verni nem csak erősebb, de gyakrabban, mert a gőz nagyobb lesz. Egyidejű hatása e két tényező az úgynevezett exponenciális növekedés a telített gőz nyomása.
2.7.4 páratartalom
A levegő vízgőzt tartalmazó úgynevezett nedvesen. Minél több gőz a levegőben, annál nagyobb a páratartalom.
Abszolút páratartalom a parciális nyomása vízgőz levegőben (azaz. E. A nyomás, hogy a vízgőz által nyújtandó önmagában, annak hiányában a többi gáz). Néha az abszolút páratartalmat a sűrűség vízgőz a levegőben.
Relatív páratartalom „az aránya a parciális nyomás a vízgőz benne nyomáson telített vízgőzt át ugyanezen a hőmérsékleten. Általános szabály, hogy
az arány százalékban kifejezve:
Egyenletből Mengyelejev-Clapeyron egyenlet (2.6), hogy a gőznyomás arány az arány a sűrűségek. Mivel (2.6) önmagában, visszahívás, leírja telített gőz csak hozzávetőlegesen, megvan a hozzávetőleges kapcsolatban:
Az eszközök egyike, amelyek mérik a páratartalom, a nedvességmérő. Ez magában foglalja a két hőmérő, egy tank, amely csomagolva egy nedves ruhával. Minél alacsonyabb a nedvességtartalma, annál intenzívebb a víz elpárolgása megy a szövetből, annál nagyobb a hűtési tartály ¾mokrogo¿ hőmérővel, és minél nagyobb a különbség a mért értékeket és a száraz hőfok leolvasás. Ez a különbség egy speciális páratechnikai táblázat meghatározott páratartalom.