Emelése és süllyesztése a forráspontja a kristályosodási hőmérséklet az oldat
Forráspont egy fázisátalakulás, amely az átalakítás a folyadékpárolgási, a gőz képződött buborékok a teljes folyadék térfogatának.
A hőmérséklet a forrásban lévő folyadék nevezzük azt a hőmérsékletet, amelyen a telített gőz nyomása ez a folyadék egyenlő a külső. Ezen a hőmérsékleten, és a megfelelő telített gőz nyomása közötti egyensúlyt a folyékony és gáznemű fázisok (párolgási sebesség egyenlő a kondenzáció sebességét), és mindkét fázist együtt is hosszú ideig. Ha folyékony - egyéni anyag és a külső nyomás nem változott, akkor forralás nyitott edényben állandó hőmérsékleten lép fel egészen addig, amíg teljesen eltűnik folyadékfázis. A hőmérséklet, amelynél a folyadék forrni kezd ebben a 101325 Pa nyomáson, az úgynevezett normál forráspont.
Fagyasztás (megszilárdulás) képviseli a fázisátalakulás, amely az átalakítás a folyadékot egy szilárd, amelynek részecskéi (kristályok) vannak kialakítva, a teljes folyadék térfogatának.
Fagyáspont (kristályosítás) folyadékot nevezzük a hőmérséklet, amelynél a gőznyomás a folyadék megegyezik a nyomás a telített gőz fölött a csepp ki a szilárd fázis kristályok. Ezen a hőmérsékleten, és a megfelelő telített gőz nyomása közötti egyensúly folyékony és szilárd fázis (a kristályosodás sebessége a sebessége olvadás), és mindkét fázist együtt is hosszú ideig. Ha folyékony - egyéni anyag és a külső nyomás állandó marad, majd amikor hűtjük a hőmérséklet állandó marad megfelelő a fagyáspont, amíg amíg a teljes megszilárdulás.
Annak érdekében, hogy elmozdulás az egyensúly felé a kristályosodási hőmérsékletet csökkenteni kell, mert kristályosodás - exoterm folyamat. Ha feloldjuk egy folyékony anyag esetében, annak koncentrációja csökken, és a folyadékot a rendszerben - a szilárd fázis növeli az olvadási folyamat. Ezért a kapcsolat (II Raoult-törvény):
Növelése a visszafolyatás hőmérséklete, valamint csökkenti a kristályosodási hőmérséklete a hígított oldatot közvetlenül arányos a molalitás az oldat és független a az anyag jellegét.
ahol: IR - ebullioskopicheskaya és oszmométerek állandó (függ az oldószer jellegétől, nem függ a természet és anyag-koncentráció)
Tulajdonságok és mechanizmusok kialakulását folyékony oldatok változtatható, így teremt egy egységes elmélet megoldások összefüggő jelentős nehézségeket. Számos szempontból, hogy milyen jellegű a megoldás: a fizikai, kémiai és összetett.
A mechanizmus a kioldódási alatt komplex modell lehet képviseletében a három lépésből áll: 1) a tájékozódás a poláros oldószer molekulák szemcsék körül az oldott anyag, ionképződést - dipol kötésekkel; 2) break kötvények az oldott anyag; 3) szolvatációját ionok oldatban.
Az első két szakaszban kapcsolatos kiadások az energia, és a harmadik a megjelenése. energia arány határozza meg a hő az oldódás, és így az exoterm vagy endothermicity amit az oldódási folyamat.
Ismeretes, hogy a szerkezetében lévő folyadék egy közbenső helyzetben a gázok, amelyben a molekulák véletlenszerűen vannak elrendezve, és a kristályok, ahol a részecskék egy bizonyos távolságra egymástól a kristályrácsban. A folyadékokat megőrzött néhány eleme a rendezett szerkezet. Például, úgy véljük, hogy a víz a jég részben megtartja a struktúrája, ahol minden molekula négy hidrogénkötések szomszédos molekulák.
Az oldatot képezve miatt új interakciós erők a részecskék között megbomlik szerkezete a tiszta folyadékok. Van egy új struktúra egy másik elrendezése a részecskék és más kölcsönhatás közöttük. Mindez nagyban befolyásolja a lezajló folyamatok megoldásokat.
oldat tulajdonságainak lényegében attól függ, annak összetétele. Ezért a legfontosabb jellemzői a megoldás annak összetevők koncentrációja. Módon kifejező különböző koncentrációjú. Sokkal valószínűbb, hogy használni:
1. A moláris frakciót - az arány i - komponens ni. az oldatban, a teljes összeg az anyag a rendszerben 1 n.
2.Obemnaya részesedése - az arány által elfoglalt térfogat i - összetevője Vi. A teljes rendszer térfogata V.
3. Mass frakció - tömegaránya I - komponens (MI) az M teljes tömegét a rendszer.
4. moláris koncentrációja, - az arány i - komponens ni. A kötet által elfoglalt rendszer V.
Moláris koncentráció kifejezése mol / m 3 mol / l. Használhatják a M.
5. molal koncentráció vagy molalitás - aránya I - komponens ni. olvadáspont súlyt az oldószert.
Molal koncentrációt fejeztük ki mól / kg. Például, a kifejezés „odnomolyalny oldat”: olyan oldat, amely egy mól oldott anyag 1 kg oldószer.
6. mólekvivalens koncentrációja - az arány ekvivalens i anyag által elfoglalt térfogat a rendszer.
Mólekvivalens koncentráció kifejezése mol / m 3 mol / l. Ez lehetővé tette a kijelölési n.
A bevezetése az oldott anyag az oldószerbe oldjuk folyamat - az idő múlásával spontán módon, azaz a az oldatot telítetlen, akkor a megoldás át számos anyagok. Amikor az oldat telítetté válik, hogy egy ilyen rendszer lehet egyidejűleg végtelenségig anélkül, - bármilyen változás oldat és feleslegben oldott anyag. Egyensúlyi állapot lehet törött csak a hőmérséklet-változás, a nyomás vagy a bevezetése más anyagok. A túltelített oldatát az anyag koncentrációja nagyobb, mint a telített (egy adott hőmérsékleten és nyomáson), akkor előállítható óvatosan és lassan lehűtjük a telített hőmérséklet magas sóoldatban egy gyenge sav (tioszulfátok és acetátok alkálifémek). Túltelített oldatot egy olyan rendszer, amely a látszólagos egyensúlyi. Rázó vagy belépő bele kristályok azonos anyag, amely az oldatban, a kristályosítás, van egy elosztása feleslegben oldott anyag és az oldatot telítődik.
A az anyag oldhatóságát egyenlő koncentrációja telített oldatban. A különböző anyagok esetében ez nagyon változó. Egyáltalán nem oldhatatlan anyagokat. Az oldékonyság függ az anyag jellegét, annak halmazállapotban és a külső körülmények (hőmérséklet, nyomás, stb). Oldódása után bizonyos anyagok a szerződő - kompressziós rendszer térfogata: térfogatú oldatot valamivel kisebb, mint az a mennyiség az oldott anyag és az oldószer. Így összekeverésével 48 térfogatnyi vizet 52 térfogat etanollal hőmérsékleten 293 K helyett 100 térfogatrész kapott keverék csak 96,3. Ez annak köszönhető, hogy a kölcsönhatás a alkoholt és vizet, hogy hidrátok és vzaimouplotneniem azok molekulák a térben.
Gázok oldódnak a testnedvekben, de nem végtelen, hanem egy bizonyos határt, a kialakulását a megfelelő telített oldattal. Miután elérte a telítettségi dinamikus egyensúlyi állapot jön létre az oldat és a gáz fölé. Ez az egyensúly az jellemzi, hogy egységnyi idő száma gázmolekulák a folyadék révén felülete megegyezik a molekulák száma a távozó gáz a folyadék.
Feloldódását gázok szinte mindig kíséri a hőtermelés (mivel a szolvatációjának molekulák). Szerint a Le Chatelier-elv, a oldhatósága gázok növekvő hőmérséklettel csökken, és növeli a hűtési.
Henry-törvény (1803) fejezi a függőség a oldhatósága gáznyomás: oldhatóságát a gáz a folyadék arányos a nyomás alatt a folyadék: C = Cr,
ahol a C - gáz koncentrációját a folyékony, k - arányossági tényező jellegétől függően a gáz, p - a gáz nyomása az oldat felett.
A kötet a oldott gáz független a külső nyomás, mivel a nyomás növekedésével ugyanazzal a tényezővel növeli a koncentrációt az oldott gáz és a gázalakú az oldat felett. Így, az oldhatóság, a gáz a folyadék arányos annak parciális nyomása.
A nitrogén parciális nyomása körülbelül 4-szer az oxigén parciális nyomása. Ezért, hogy növeli a nyomást, az oldatot nitrogénnel dúsított.
Az ilyen megoldások ideálisak, a komponensek keletkeznek, hozott egy hasonló állapotban aggregáció és bármilyen arányú, nem kíséri volumenváltozásokat és termikus hatás, és a változás a entrópia egyenlő a változás entrópia összekeverése során ideális gázok:
Dalton-törvény: Amikor az oldott gázok a folyékony keveréket, minden gáz feloldódik egyenesen arányos a parciális nyomása.
Jellegétől függően a folyadékok alkotó rendszert különböztetünk meg:
álló rendszerek végtelenül elegyedő folyadékok (víz és etil-alkohol, víz és ecet lényege)
álló rendszerek korlátozott oldódó folyadékok egymással (vizet és anilint, víz és éter)
rendszer gyakorlatilag nem oldódnak egymásban folyadékok (víz és benzin, a víz és a higany).
A hőmérséklet, amelynél a korlátozott oldékonyság korlátlan, az úgynevezett kritikus oldhatósági hőmérséklet.
A kölcsönös a komponensek oldhatósági növelhető vagy csökkenthető bevezetésével egy harmadik komponenst.
Például, anilin lehet végtelenül elegyedik vízzel minden hőmérsékleten, ha a rendszer tartalmaz elegendő mennyiségű lítium-jodid (pl. K. A só egyformán jól oldódik mind folyadékok). Előfordul, hogy a bevezetése a harmadik komponens lehetővé teszi, hogy át egy homogén, kétfázisú oldatot. Például, annak érdekében, hogy megkülönböztessük a etil-alkohol vizes oldat, ez elég ahhoz, hogy hozzá kristályos káli- és erőteljesen rázzuk. Ülepítés után az oldatot szétválasztjuk két nem elegyedő rétegeket.
Jellemzően, kezelt oldatok folyadékokban levő szilárd. Tulajdonságok megoldások engedelmeskedik a három törvény által megfogalmazott Raul és a negyedik - van't Hoff.
A tulajdonságok a híg oldatok nem függ a az anyag jellegétől, és csak attól függ a koncentráció az úgynevezett Collegiate. Ezek közé tartozik az ozmotikus nyomást, csökkenti a gőznyomás az oldat felett, csökkenti a kristályosodási hőmérséklet és növeli a forráspontja a megoldás.
Szerint a Raoult-törvény gőznyomása a híg oldat alacsonyabb, mint a tisztán oldószert.
Fontos szerepet játszik a szervezet a növények és állatok játszik jelenség az ozmózis. Ozmózis - kétoldalas diffúziós folyamat oldószert egy féligáteresztő membránon keresztül egy oldat kisebb koncentrációban, hogy a megoldás nagyobb koncentráció.
Híg ozmózissal nem függ kifejezetten típusától az oldott anyag és oldószer. Döntő oldat koncentrációja. Az anyagok, amelyen keresztül az oldószer áthalad, és nem jut át az oldott anyag nevezett féligáteresztő.
Van't - Hoff:
A nagysága az ozmotikus nyomás függ a koncentrációja az oldott anyag.
Megsértése ozmózis és a változás az ozmotikus nyomás a szervezetben vezet kívánatos következményei. Süllyesztése ozmotikus nyomás által okozott bevezetése a test egy nagy mennyiségű felesleges vizet, vagy a veszteség sók, mint például a verejték. Ez okozhat hányást, görcsöket, és súlyos esetekben - halálához vezet a szervezet. A megnövekedett ozmotikus nyomás bevezetése miatt a szervezet a felesleges só és víz újraelosztása, ami a szövetekben felhalmozódnak fölösleges sókat és duzzanat jelenik meg.
Ozmotikus nyomás az egyik oka a víz mozgását a növények és emelje ki a gyökér a tetejére. Leveleiből növények hatása alatt a légköri folyamatok, a víz elpárolog, a veszteséget kompenzálni ozmotikus szívó az őssejtek.
Egy oldatot eltérően a tiszta oldószer nem fagy állandó hőmérsékleten. Kristályok kezdenek állni, amit - ugyanazon a hőmérsékleten, mint a hőmérséklet csökken számuk növekszik, amíg az egész oldatot fel nem alakítjuk szilárd fázisú. A hőmérséklet, amelynél a kapott oldatot lehűtjük kristályok kialakulása megkezdődik nevezzük a fagyáspont az oldat. át-fagyasztási hőmérsékleten az oldószer kristályok egyensúlyban vannak oldattal Egy adott készítmény.
A tapasztalat azt mutatja, hogy a híg oldat megfagy alacsonyabb hőmérsékleten, mint a tiszta oldószer. A különbség a fagyasztási hőmérséklet és az oldószer oldatot nevezzük csökkenti a fagyáspont # 916; t.
k - oszmométerek állandó. Ez az érték számszerűen egyenlő odnomolyalnogo csökkenti a fagyáspontja megoldást, feltéve, hogy továbbra is tökéletes. az oldott anyag nem disszociál és a munkatársak. Oszmométerek állandó természetétől függ az oldószer és a nem jellegétől függ az oldott anyag. Víz - 1,86; fenol - 7,27, benzol - 5,10 CGC / mol. Ez azt jelenti, hogy amikor feloldjuk ezeket az oldószereket, azonos koncentrációjú anyag egyenlő a legnagyobb csökkenti a fagyasztási hőmérséklet figyelhető fenol legkisebb vízben.
Ennek eredményeként a gőznyomásának csökkentésére az oldat feletti növeli a nem illó anyag az oldat forráspontja közötti hőmérsékleten. A jelenléte az oldott anyag növekedését okozza forráspontja közötti hőmérsékleten az oldat.
E - ebullioskopicheskaya állandó. Ez attól függ, az oldószert. Víz 0,51, fenol - 3.04.
Nem szabad elfelejteni, hogy a hőmérséklet felett a forrásban lévő oldathoz képest a víz forráspontja közötti hőmérsékleten. Ezért éget forrásban lévő megoldások több fájdalmas, mint égések forráspontú oldószereket.
Előadás 4 „elektrolitos disszociáció vizes oldatban”
Anyag - elektrolitok:
1. oldható bázisokat - alkáli,
2. savak
3. oldható sót.
Oxid elektrolitok nem, t. Hogy. Ezek nem egyszerűen oldjuk vízben, és adja be egy kémiai reakció, amely egy-hidroxid, amelyek előfordulnak dissotsiiruet.Neredko anyagot, amelynek molekulája két típusú kapcsolat figyelhető meg. Például, a nátrium-hidroxid - NaOH nátrium-gidroksogrupp kapcsolódik ionos kötést, és a hidrogén és oxigén - kovalens. A molekulában H2 SO4 kénsav hidrogén kötés a savas maradék a polárosabb, mint kén kötéssel oxigénnel. Az alumínium-nitrát Al (NO3) 3 alumínium-kötött savas maradékot ionos kötést, és a nitrogénatommal, oxigénatommal - kovalens. Ilyen esetekben, felbomlása a molekula ionok történik helyén a legtöbb ionos vagy poláros kötések hasításához, amely kevesebb energiát igényel.
Ebből az következik, hogy az ionokat képezhetők nem csak az egyes atomok, de atomcsoportok. Például SO4 2. NO3 -. OH -.
bevezette a disszociációs mértéke kvantitatív jellemzésére az elektrolitikus disszociáció (a):
a = -----. ahol n - molekulák száma a szilárd anyagot, törött ionokra;
N N - molekulák száma az anyag vezettünk be az oldatba.
Attól függően, hogy a disszociációs mértéke minden elektrolit hagyományosan osztva erős (a = 1) és a gyenge (egy<1). Степень диссоциации зависит от природы электролита, температуры и концентрации раствора.
Az erős elektrolitok közé tartoznak az erős ásványi savak HCI, H2 SO4. HNO3. HMnO4 et al. Alkálifémek és alkáliföldfémek, és az összes oldható sók.
Gyenge elektrolitok közé tartoznak majdnem az összes szerves anyagot, gyenge sav H2 CO3. H2 S, HNO2. H2 SiO3. H3 PO4, a maradék bázis, és sok H2 O bináris vegyületek, oxidok és mások.
Írásban az egyenleteket elektrolitos disszociáció, tudatában kell lennie, hogy:
disszociációs több bázisú savak és bázisok mnogokislotnyh fordul elő lépésenként;
erős elektrolitok disszociációs egyenlete az első szakaszban vannak rögzítve, mint egy visszafordíthatatlan folyamat, és minden ezt követő - mint reverzibilis (kivéve alkáli- és alkáliföldfémek).
gyenge elektrolitok disszociál reverzibilisen minden következő lépéseket:
Amfoter hidroxidok gyenge elektrolitok, és disszociálnak mind a bázis típusa és sav típusú szerint:
Jellemzésére a gyenge elektrolitok használt mennyiséget nevezzük disszociációs állandó.
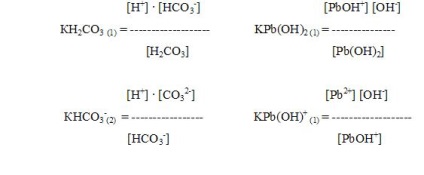
A disszociációs állandó és disszociációfok vannak a matematikai összefüggés (a törvény a hígítás). csökkenő oldat koncentrációja (C) disszociációs mértéke (a) elektrolit növekszik.
A törvény hígítási állíthatjuk elő képletekkel kapcsolatos disszociációs állandója a gyenge elektrolit, disszociációs mértéke, és az ion-koncentráció (Zion). Sőt, mivel
Ez könnyen belátható, hogy a Sion és C = a Sion = K / C