Elektródpotenciálok - studopediya
Elektrokémiai berendezések és eljárások
Mivel a redox reakció kíséretében díj átadása, tudják hajtani az elektromos áram, és fordítva -, hogy megkapja az elektromos áram miatt szivárgást. A megfelelő eljárások és eszközök használata elektródák és az elektróda potenciál.
A koncepció a potenciálja.
Ha az alsó fémlemez vízben vagy egy oldatot tartalmazó ionokat a fém, majd a fém-oldat folyamatok miatt a fém oldódását-lerakódás történik különbség vagy potenciális ugrás, ami függ a fém természetétől, az oldat koncentrációja és a hőmérséklet. Ezt ugrás az úgynevezett elektród potenciál a fém. Az említett egyensúlyi expresszálódik egy egyenletnek, amely figyelembe veszi a hidratálási ion:
oldatban a fém
A lehetséges megfelelő ezt az egyensúlyt, az úgynevezett egyensúlyi potenciálja.
J értékét lehetetlen meghatározni az abszolút érték. Ezért a potenciáljai valamennyi elektród tekintettel határozzuk meg, hogy a standard hidrogén félcella (elektród) (lásd a 7.1 ábra.), Amely a potenciális határozzuk nullának: j körülbelül 298 (2H + ® H2) = 0. A standard hidrogén elektród áll egy hajó 1 n. savas oldatot, amely elhagyható platina elektród érintkezésbe hidrogéngázzal. túlnyomásos P = 101,3 kPa.
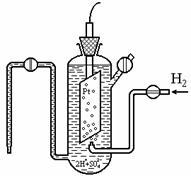
Ábra. 7.1. Standard hidrogén elektród
Az elektróda egyensúly jön létre 2H + p + 2? H2 (g). A nulla érték j erre elektród határozza meg az a tény, hogy a DG 0 F (H +) = DG 0 f (H2) = 0. Platinum használják tehetetlensége folytán, hanem azért is, mert ez egy katalizátor elektrontranszfer (megállapításának folyamata egyensúlyi felgyorsítja de egy egyensúlyi állapot is, azaz a függvény DH, DU, DG, DS, változatlan marad állandó hőmérsékleten).
Potenciálok viszonyítva meghatározott standard elektród standard körülmények között (azaz körülbelül 298 j) táblázatba. A fémek kémiai adatok (NN Beketovym) mérjük az j 298 beállított számú fém aktivitás, ami jelenleg nazavanie elektrokémiai feszültség sorozat fémek (tabl.12.1).
Standardpotenciál egyes fémek j 0
Az elektróda potenciálja standard körülmények között mért
(T = 298 K, [Me: n +] = 1 mol / l) viszonyítva a standard hidrogén elektród, az úgynevezett standardpotenciál a fém és a jelöli j 0. A standardpotenciál kvantitatív jellemző kémiai aktivitása a fém, azaz azt a képességét, hogy adják fel a vegyérték elektronok és megy oldatba, mint ionok.
Az alapvető tulajdonságait számos feszültséget.
Minél kisebb az érték j, a kifejezettebb aktivitása redukáló fém.
Ha a feltételek eltérnek a standard, hogy ki lehessen számítani az elektród potenciál Nernst képlet használható:
ahol j 0 - standardpotenciál a fém,
n - az elektronok száma a folyamatban részt vevő,
F - Faraday állandó (96,500 C / mol),
R - egyetemes gázállandó (8,31 J · mol - 1 · K - 1)
T - abszolút hőmérséklet (K).
Ha a fenti egyenlet helyett a folyamatos számszerű értékek, akkor a következő formában:
A Nernst képlet azt mutatja, hogy a standard koncentrációja kationok egyenlő 1M φ = j 0. azaz egyensúlyi potenciálja a fém elektród megegyezik annak standard potenciálja.