A főbb rendelkezések az MBC
1. A kovalens kémiai kötés alakul ki a két elektron ellentétes forog, ahol az elektron pár tartozik két atom.
2. A kovalens kötés az erősebb, annál az átfedés kölcsönható elektron felhők.
Írásakor szerkezeti képletek elektron párokat, amelyek hozzájárulnak a kommunikálni ábrázolása gyakran kötőjellel (helyett reprezentáló pontok elektront osztott).
Fontos jellemzője az energia a kémiai kötések. Amikor kémiai kötés teljes rendszer energia (molekulák) kevesebb energiát komponensek (atomok), azaz EAB<ЕА+ЕB.
Valcncy - az ingatlan egy kémiai elem kapcsolódó atom vagy cserélje bizonyos számú atomok másik elem. Ebből a szempontból, a vegyértéke az atom legegyszerűbb száma határozza meg a hidrogénatomok alkotó kémiai kötést, vagy a hidrogénatomok számának szubsztituálható atomja az elem.
A fejlesztés a kvantummechanikai ábrázolások az atom vegyértéke acél számának meghatározására párosítatlan elektronok részt vevő kialakított kémiai kötésen. Továbbá párosítatlan elektronnal, a vegyérték atom is függ a száma az üres és teljesen megtöltött vegyérték-elektron pályák réteget.
A kötési energia - az energia, amely során felszabaduló kialakulását molekulák atomok. Kötési energia általában kifejezve kJ / mól (vagy kcal / mol). Ez az egyik legfontosabb jellemzője a kémiai kötés. Annál stabilabb a rendszer, amely kevesebb energiát tartalmaz. Ismeretes, például, hogy a hidrogénatomok a molekula hajlamosak, hogy egyesítse. Ez azt jelenti, hogy a rendszer, amely a H2 molekulák kevesebb energiát tartalmaz, mint olyan rendszer, amely azonos számú H-atomok, de nem szerepel a molekulában.
Ábra. 2.1 A függőség E rendszer potenciális energia a két hidrogénatom az internukleáris távolság r: 1 - a kialakulása egy kémiai kötés; 2 - anélkül, hogy a tanulmányait.
2.1 ábra mutatja a teljesítmény görbe, amely jellemző a kölcsönható hidrogénatomok. Konvergencia atomok kíséri az energia felszabadítását, melyik lesz a nagyobb, a nagyobb az átfedés az elektron felhők. Azonban, normál körülmények között, mivel a Coulomb-taszítás, lehetetlen elérni fúzió a sejtmag a két atom. Tehát egy bizonyos távolságra, hanem a vonzás az atomok, a taszítás lép fel. Így a távolság atomok közötti r0, amely megfelel legalább az energia a görbe megfelelnek kötéshossz (1 görbe). Ha a kölcsönható elektron pörgetés hidrogénatomok azonos, akkor a taszítás lép fel (2-es görbe). A kötési energiája az atomok különböző tartományok 170-420 kJ / mól (40-100 kcal / mol).
Az átalakulási folyamat egy elektron magasabb energia szinten, vagy szintalatti (azaz gerjesztési folyamat vagy a szétválasztás, amelyet korábban már említett) energiát igényel. Ha kémiai kötés kialakulása energiát kiválasztása történik. A kémiai kötés stabil volt, szükség van, hogy növelje az energia az atom miatt gerjesztési energia kisebb volt kémiai kötés. Más szóval, az szükséges, hogy az energiafogyasztás a gerjesztés az atomok már kompenzálni energia kiadás miatt kötés kialakulását.
A kémiai kötés más, mint a kötési energia, jellemzi a hosszú, multiplicitás és a polaritást. A molekulák, melyek több, mint két atom, jelentős mennyiségek közötti szögek kötvények és a polaritás a molekula egészének.
A multiplicitás kommunikáció határozza száma elektron pár, két atomot összekötő. Így etán H3C-CH 3 kötést képez a szénatomok között egyszeres, etilén H2C = CH 2 - kettős, az acetilén NSºSN - tripla. A növekedést a kommunikációs multiplicitás növeli a kötési energia: az energia a C-C kötés 339 kJ / mol C = C - 611 kJ / mól, és CºC - 833 kJ / mól.
A kémiai kötés az atomok közötti oka az átfedés az elektron felhők. Ha egymást átfedő mentén történik egy összekötő vonal az atommagba, egy ilyen kapcsolat az úgynevezett szigma-kötéssel (σ-kötés). Meg lehet kialakítva, mivel a két s-elektronok, s- és p-elektronok, px-két elektron, s és d elektronokat (például):
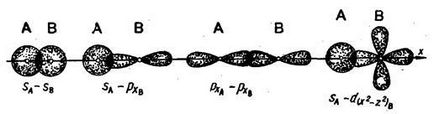
Kémiai kötéssel, végzi egy elektronpár nevezzük egyetlen. Egy kötés - mindig σ-kötés. S-típusú pályák képezhet csak σ-kötést.
Közötti kommunikáció két atom lehet több, mint egy pár elektronok. Egy ilyen kötés nevezzük többszörös. Egy példa a kialakulását a többszörös kötést lehet nitrogénatom molekula. A nitrogén-molekula px-pályák képeznek σ-kötést. A formáció a kommunikációs pz-pályák vannak a két terület
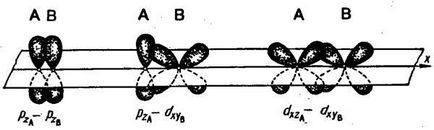
Az ilyen kötés az úgynevezett pi-kötés (π-kötés). Előfordulás π-két atom közötti kötést csak akkor következik be, ha azok már csatlakoztatva σ-kötést. A második π-kötést alkotnak egy nitrogén-molekula py orbitális atomok. A formáció a π-elektron felhők átfedés kötések kisebb, mint abban az esetben, σ-kötések. Következésképpen, a π-kapcsolat, általában kisebb, mint amilyen σ-kötések által képzett azonos atomi pályák.
p pályák képezhetnek, mint egy σ-, és π-kötés; több kapcsolat, az egyik közülük feltétlenül σ-kötés :.
Így, nitrogén molekula köti az egyik a három - σ-kötés, és két - π-kötés.
Bond hossza közötti távolság a magok a összekapcsolódó atomok. A kötéshosszak különböző vegyületeknek értékei tized nanométer. A növekedést a kötéshosszak csökken multiplicitás: kötések hosszát N-N. N = N és NºN egyenlő 0,145; 0,125 és 0,109 nm-nél (10-9 m), és a hossza kötések C-C, C = C és CºC rendre 0,154; 0,134 és 0,120 nm.
A különböző atomok tiszta kovalens kötés fordulhat elő, ha elektrootritsaelnost (EO) 1 atomok azonosak. Az ilyen molekulák elektrosimmetrichny, azaz „Központok gravitációs” A pozitív töltések a magok és az elektronok negatív töltések egybeesnek egy ponton, így hívják őket, nem poláris.
Az elmozdulás az elektron felhő az úgynevezett polarizáció. Ennek eredményeként, az egyoldalú polarizációs súlypontok pozitív és negatív töltések a molekulában nem esik egybe egy ponton, egy bizonyos távolságban (L) között történik. Az ilyen molekulákat nevezik poláros vagy dipólusok. és a kötés az atomok között ezeket nevezzük poláris.
Polar kötés - egyfajta kovalens kötés, átesett egy kisebb egyoldalú polyarizatsiyu.Rasstoyanie között „súlypontja” a pozitív és negatív töltések a molekulában az úgynevezett dipólus hossza. Természetesen, minél több polarizáció, annál nagyobb a hossza a dipólus és annál nagyobb a polaritás a molekulák. Annak megállapítására, a polaritás a molekulák általában állandó dipólmomentummal (MP), amely a termék az elemi elektromos töltés (e) a dipól hossza (L), azaz .
Dipólus momentum mért Debye D (D = 10-18 e. V. U. × cm, mert az elemi töltés 4,810-10 e. V. U. dipól hossza és az átlagos megegyezik a távolság a két mag atom, m .e. 10-8 cm), vagy coulometry (Cl × m) (D 1 = 3.33 · 10-30 Kd × m) (elektron töltése 1,6 x 10-19 coulomb szorozva a távolságot a díjak, például 0 1 nm, akkor Mp = 1,6 · 10-19 × 1 × 10-10 = 1,6 · 10-29 m · Cl). Az állandó dipólus momentum a molekulák nulláról 10 D.
A nem-poláris molekuláknak L = 0 és Mp = 0; nem rendelkezik dipólmomentum. A poláris molekulák Mp> 0, és eléri értékei 3,5-4,0 D.
A nagyon nagy különbség EO atomok kapcsolatban nyilvánvalóan egyoldalú polarizáció: elektron felhő kommunikáció maximálisan felé mozduljanak, az atom a legnagyobb EO atomok átjut ellentétes töltésű ionok és ionos molekula fordul elő:
Kovalens kötés válik ionos. Elektroasimmetriya molekulák növekszik, a dipól hossza növekszik, dipólmomentum növeli a 10 D.
A teljes dipólusmomentuma komplex molekula lehet tekinteni egyenlő a vektor összege dipólusmomentumának az egyes kötvények. A dipólmomentum általában úgy kell irányítani a pozitív vége a negatív dipólus.
Tippeld bekötési polaritást lehet keresztül relatív EO atomok. Minél nagyobb a különbség a relatív EO atomok, annál kifejezettebb polaritása DEO = 0 - apoláros kovalens kötés; DEO = 0-2 - poláris kovalens kötés; DEO = 2 - ionos kötéssel. Helyes beszélni fokú ionos jellegű kommunikáció, mert a kommunikáció nem történik 100% ionos. Még az Egyesült cézium ion kötés csak 89%.
Kémiai kötés miatt előfordul, hogy az átmenet az elektronok egy atom a másikra, az úgynevezett ion. és a megfelelő molekulák kémiai vegyületek - ion. Az ionos vegyületek szilárd állapotban jellemző ion kristályrácsban. Az olvadt, és oldott állapotban vannak vezeti az áramot, hogy egy magas olvadáspontú és forráspont és jelentős dipólus momentum.
Ha figyelembe vesszük a kapcsolat elemeinek időtartama egy és ugyanazt a tételt, akkor a mozgás kezdetétől a végéig terjedő időszakra elsősorban ionos jellege helyébe kovalens. Például, a fluoridokat 2. időszakától LiF, BeF2, CF4, NF3, OF2, F2 iontartalma közleménye lítium-fluorid és fokozatosan gyengíti jellemzően helyébe kovalens kötéssel egy molekula fluoratom.