A világ kristályok - drágakövek, ásványok, kristályok növekedését, azok tulajdonságainak és szerkezetének
Amint képződik olvadékok
Kötési magma - a folyamat a kristálynövekedés az olvadékból. Melegítés hatására a szilárd anyagot megolvasztják (ha, persze, hogy nem égtek el vagy bomlottak alkotórészeire). De kiderül, hogy a kristályok és az amorf anyagok (üveg) elolvad teljesen más.
Minden kristályos anyag olvadni kezd teljesen egy bizonyos hőmérsékleten. Melegítsük fel, például ón kristály és így méri a hőmérsékletet 100, 200, 220, 225 ° C - nem változik a kristály. Hirtelen át 231,9 ° C-on a kristály kezd olvadni. Nem számít, hogy hányszor ismételjük ezt az élményt, akkor nem lesz képes, hogy olvad az ón kristály 231 ° C vagy alacsonyabb, és fordítva, nem tudjuk tartani azt a 232 ° C-on vagy annál magasabb - mindig kezd olvadni 231,9 ° C, kivéve, ha csak a tapasztalat atmoszferikus nyomáson végezzük, és semmilyen ón szennyeződések.
És ha van a jelenség a túlhűtés, ami lesz szó az alábbiakban.
Mi továbbra is felmelegszik olvadó ón kristály. Bár fűtési hőmérséklet Tin már nem növekszik: során az egész olvasztási marad egyenlő 231,9 ° C Csak ha olvadó befejeződött, a hőmérséklet Tin - már nem a kristály és egy olvadék folyékony - kezd emelkedni, kivéve, ha továbbra fűtés .
Crystal a só Olvadáspont pontosan 804 ° C-on, kvarckristály, 1470 ° C-on minden kristály Olvadáspont egy bizonyos hőmérséklet úgynevezett az olvadási hőmérséklet. Ezen a hőmérsékleten a kristályos szerkezet összeomlik, lebontja a helyes működését a részecskék megbízásából aprítja sportolók a csapat „szakítani!”. Minden kristályok azonos anyag állandó körülmények között az olvadási hőmérséklete azonos, de eltérő a különböző anyagok. Minden kristályok olvadása során állandó hőmérséklet fenntartásához. Ez az a tulajdonság a kristály alapú eszköz egy hőmérőt. Nulla fok hőmérő - az a hőmérséklet, amely normál körülmények között az olvadás, azaz olvad jégkristályok.
De mi a helyzet, nem kristályos szilárd olvadnak? Fűt bármely amorf anyag, mint például egy egyszerű üveg, már nem vagyunk képesek meghatározni a hőmérséklet, amelyen olvadni kezd, úgy, hogy az amorf anyag fokozatosan megolvad, lágyítja, annál kevésbé lesz és kevésbé viszkózus, és végül teljesen folyékonyak. Ez érthető: elvégre nincs szükség semmilyen csapat megtörni a rendszert, mivel az összes üvegrészecskék, még a melegítés előtt elrendezett véletlenszerűen.
Ha az üveg megolvad egyszerre, mint egy kristály, lehetetlen lenne robbantani és alakja a ételeket. Csak annak a ténynek köszönhető, hogy az üveg meglágyul vagy megkeményedik fokozatosan, üvegfúvó fúj és formáz meg, így ez bármilyen alakú.
Amelynek állandó olvadáspontja különbözteti kristályos testek nem kristályos. A kristályokat azonnal olvadni kezd egy bizonyos hőmérsékleten és nekristally (és sok keverékei kristályos anyagok) fokozatosan lágyítja - nincs határozott olvadási pontjuk. " Ennek alapján lehet megkülönböztetni a kristályos anyag nem kristályos. Például, a jég olvadni kezd nulla fok, majd a jég - az anyag kristályos, és a gyantát, aszfalt, műanyagok, zselatin, Var, asztalos ragasztó fokozatosan meglágyult, - eszközöket, ezek az anyagok nem kristályos, de amorf.
De ez mindig ugyanaz a kristályos olvadáspontját „ugyanazt az anyagot? Nem tudja megváltoztatni? Kiderült, amennyit csak tudsz. Az a tény, hogy az olvadáspontja a kristály a nyomástól függ, amelyek mellett a kristály. Például, a jég elolvad, vagyis olvadáspontja 0 ° C-on légköri nyomáson (körülbelül egy atmoszféra). Ha a nyomás növelése, a jég elolvad alacsonyabb hőmérsékleten, és még egy pár fok. Alatt nyomást meghaladó normál légköri nyomáson 100, olvadó jég át - 0,9 ° C-on, és ha a nyomás tizenöt százszor nagyobb, mint a légköri nyomás, jég olvad már -14,1 ° C-on
Nyomás befolyásolja olvadáspontja kristályok egyáltalán, ez a hatás eltérő a különböző anyagok: egyes erősebb, gyengébb, mint a másik; Néhány anyag nagyobb nyomás növeli a olvadáspontja, míg a másik, ellenkezőleg, csökkentette. Ez különösen igaz a mélyben a föld, ahol a nyomás, akkor több millió szer nagyobb, mint a felszínén. Ezért kristályok olvad a Föld különböző hőmérsékleteken, mint a laboratóriumban. De még ott van, a kristályok kezdenek olvadni feltétlenül egy bizonyos hőmérséklet, de a hőmérséklet - az egyes területen a nyomás.
Az olvadási hőmérséklet hatása, kivéve a nyomás egyéb okok miatt, mint például a szennyeződések az egyéb anyagok az olvadékban. Például, olvadáspontja tiszta vas és a tiszta szilícium nagyon magas, de oxid keverékének ezen elemek mésszel olvad sokkal alacsonyabb hőmérsékleten. Ez az alapja egy eljárás olvasztására vasércek tartalmazó szilícium-dioxid. Az elegyhez mészkő érc; szilícium-dioxid, mész és egy kis töredéke a vas alkotnak egy alacsony olvadáspontú salak, amely úszók és elválik a több tűzálló tiszta vas.
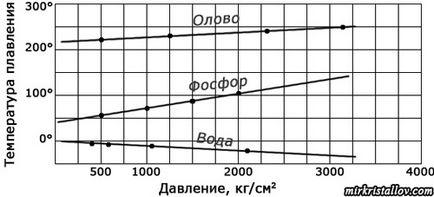
A függőség olvadási hőmérséklete az egyes anyagok a nyomást.
Ha ehhez hozzáadjuk a jég közönséges asztali só, jég olvadási hőmérséklete erősen csökken. Köztudott, hogy a sós tengervíz megfagy alacsonyabb hőmérsékleten, mint a friss vizet. A keveréket egy rész só és három rész vízzel nem olvad 0 °, de csak -23 ° C-on keverés jeget kalcium-klorid, a hőmérséklet csökkenés érhető el akár -55 ° C-on Ez a tulajdonság a jégkristályok előállítására alkalmazott hűtőberendezések, ha jég megszórjuk sóval, például fagylalt készítő, a hőmérséklet az olvadó jég drámaian csökken.