Rendelet enzimaktivitás
Az egyik az egyedülálló tulajdonságokkal élőlények az ő méltó képessége az egyensúly megtartása katabolikus (biodegra-dativus) és anabolikus (bioszintetikus) folyamatokat. A sejteket egyidejűleg végbemegy eljárásokkal számos, bomlás és egymásba a több száz vagy több ezer különböző anyagok. ami viszont szabályozza a különböző mechanizmusokat, amelyek biztosítják a állandóságát a belső környezet a test. Néhány ilyen szabályozási mechanizmusok, amelyek között fontos szerepet játszik a szabályozási mechanizmust a szintézis, a katalitikus enzimek aktivitását. Ezeket később tárgyaljuk.
A hatása a tömeghatás törvénye. A reverzibilis enzim-katalizált kémiai reakció. így például A + B <=> C + D, koncentrációja a reakció komponenseket, és így az irányt a reakció lesz irányadó a befolyása a tömeghatás törvénye. Ez, különösen, lehet látható reverzibilis transzaminálás reakciót. enzim katalizálja az alanin-aminotranszferáz:
alanin + # 945; ketoglutarát <=> A piruvát + glutamát.
Ez a fajta szabályozás játszik nyilvánvalóan csak korlátozott szerepet, mivel a tényleges körülmények között a reakció általában egy irányban, mivel a kapott termékek lehetnek szubsztrátjai a fellépés más enzimek, és kimenete a reakciózónába. Ezekben az esetekben ez határozza meglehetősen stabil (álló) állapotban van, mint a valódi egyensúlyt.
Megváltoztatása az enzimmennyiség. A baktériumokat alaposan tanulmányozták a jelenség által indukált (indukáló) szintetizáló enzim növesztve a táptalajhoz, amelyben az egyetlen szén- és energiaforrás egyik vagy másik szénhidrát. például glükózt. Cseréje a glükóz a közegben a laktóz (inducer) vezető indukált vagy adaptív (miután egy kis lag fázis időszak) szintézis enzim galaktozidáz (programozott laktóz génjéből. Lásd CHAP. 13), amely lehasítja a laktózt glükózra és galaktóz.
A sejteket a prokarióták és eukarióták olyan enzimek. koncentráció, amely nem igényel egy indukáló anyag hozzáadása; az úgynevezett konstitutív enzim. Az enzim mennyiségét a sejtben jelenlététől függ a reakció terméket. által katalizált ezt az enzimet. ahol a reakciótermék okozza szintézisének gátlása az enzim eredményeként az elnyomás (lásd., stb).
Az állati szövetekben gyors szintézise enzimek kevésbé gyakori. A mechanizmus (indukáló szintézis) vizsgálták csak egy kis számú enzimek. tirozintransaminazy, szerin és treonin, stb triptofanpirrolazu -. válaszul vételére bevezetésének hormonok vagy fehérje. Azonban, ha a szervezet az egyes mérgek, rákkeltő anyagok. alkaloidok. inszekticidek néhány nap, egy éles aktivitásának növekedését (vagy mennyisége) hidroxiláz enzimek (monoxigenázok) endoplazmatikus retikulum a máj sejtek. oxidáló idegen anyagoknak nem-toxikus termék a szervezet számára. Ez elfogadható, azt feltételezni, hogy ilyen esetekben fordul elő indukálásával szintézisének enzimek (azaz a de novo). Vannak olyan esetek, amikor az akció hidroxilázokat ilyen idegen anyagok átváltandó a test egy több toxikus vegyület. Ez a jelenség, az ellenkező méregtelenítés, már az úgynevezett halálos szintézist.
Proenzimjeik. Proteolitikus enzimek az emésztőrendszer, és a hasnyálmirigy szintetizálódnak inaktív formában - például a proenzim (zimogének). Rendelet ezekben az esetekben csökken átalakítani zimogének aktív enzimek a hatása specifikus szerek vagy más enzimek - proteinázoktól. Így tripszin szintetizálódik a hasnyálmirigy formájában inaktív tripszinogén. Bevitele a bélbe, ez átalakul aktív tripszin kapott autokatalízis vagy hatása alatt más proteázok (aktivált mechanizmust tárgyalja részletesen a 12. fejezetben). Conversion Pepsi nogena inaktív át aktív pepszinnel történik autokatalitikusan által specifikusan korlátozott proteolízissel a hidrogén-klorid jelenlétében, és szintén kapcsolatban van a hasítási a proenzim specifikus inhibitor peptid. Ezek az átalakítások a zimogének aktív enzimek kapcsolódó konformációs változásokat az enzim molekulákat és a kialakulását az aktív centrum vagy feltáró (leleplezését). Szintézise proteázok inaktív formában, és számos más inaktív prekurzor fehérjék nyilvánvalóan egy bizonyos biológiai értelemben, megakadályozza a megsemmisítése a sejttestek amelyben proenzimeket képződnek. Példák az ilyen aktiválás aktiválása bizonyos fehérjék, hormonok (proinzulin -> inzulin), kötőszöveti fehérje (oldható prokollagén átalakul az oldhatatlan kollagént), fehérjék a véralvadási rendszer.
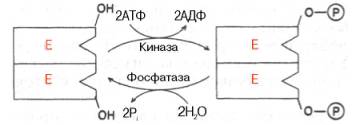
Ábra. 4.23. Kovalens módosítás foszforilezéssel enzim-defoszfo rilirovaniya szerin maradékok.
Ábra. 4.24. Nem-kovalens módosítása az enzim által poliadenilezésí deadeni-lelően.
Kémiai módosítása enzim. Számos fehérjék kialakulását harmadlagos szerkezet posztszintetikus vetjük alá a kémiai módosítás (lásd CHAP. 1). Azt találtuk, hogy a tevékenység több fontos enzimek a szénhidrát-anyagcsere. . Különösen foszforiláz, glikogén, stb is szabályozza a foszforiláció és defosforili-TION, által végrehajtott specifikus enzimek - protein-kináz és protein foszfatázok, amelyek aktivitása viszont hormonok szabályozzák (lásd 10. fejezet). Az aktivitás szintje kulcsenzimeinek a szénhidrát-anyagcsere, és így a intenzitását és irányát a csere eljárások önmaguk aránya határozza meg, a foszforilált és de-foszforilált formáinak ezeket az enzimeket.
Általában különbséget reverzibilis kovalens és nem kovalens kémiai módosítások enzimek. keresztül valósul OH-csoportot a szerin. legalább - tirozin, vagy a nem kovalens kölcsönhatások az enzim-molekula. Az első esetben az enzim aktív vagy foszfo-rilirovannaya vagy defoszforilezett forma, mint ahogy az a molekulák az izom glikogén foszforiláz és rendre (lásd CHAP. 10). Példák amely lehet formájában két áramkör jelenlegi módosítását típusú, amelyben a jel R jelentése foszfátcsoport. Pi - szervetlen foszfát (H3 PO4) PPI - szervetlen pirofoszfát (H4 P2 O7), AMP - adenilsav-maradékot (ábra 4.23, 4.24.).
Kémiai utáni módosítása enzimek közé tartoznak, továbbá, korlátozott proteolízis folyamatok (lásd. Korábban), metilezés (lásd CHAP. 13), glikozilációs uridilirovaniya, adenilezési, ADP-ribozilezés, és mások. Így egy mikroszkopikus
Allosztérikus szabályozás. Sok bioszintetikus reakciók erősen bázikus típusú többlépcsős fordulatszám szabályozás enzimatikus folyamat gátlásával visszajelzést. Ez azt jelenti, hogy a végső termék bioszintetikus lánc gátolja az enzim aktivitását. első lépését katalizálni a szintézis, ami a legfontosabb, hogy ez a láncreakció. Mivel a végtermék szerkezetileg különböznek a szubsztrátum. kötődik allostery-cal (nem katalitikus) központja az enzim-molekula. okozva ingibi-CIÓ egész szintetikus reakció-lánc.
Tegyük fel, hogy a sejtek hajtjuk bioszintetikus többlépéses folyamat, minden egyes lépését, amely enzim katalizálja saját:
Az arány az ilyen teljes reakciósor nagyban meghatározza a koncentráció a végtermék P, amely felhalmozódik feletti megengedett szintet fejt ki erőteljes hatást Ingi-biruyuschee az első eljárási lépés, és ennek következtében az enzim E1.
A fennálló ilyen mechanizmus az enzimaktivitás metabolitot találtak E. coli-ban egy szintézist vizsgálat izoleucin és CTP. Azt találtuk, hogy az izoleucin. ami a végtermék a szintézis, szelektíven gátolja az aktivitását a treonin-dehidratáz, amely katalizálja az első lépést a soros átalakítási folyamat a treonin izoleucin. Jelenleg öt enzimatikus reakciók:
Hasonlóképpen CTP, mint a végső termék a bioszintézis útvonal van gátló hatása az első enzim (aspartatkarbamoiltran-sferazu), és így szabályozza a saját szintézisét (lásd CHAP. 13). Ez a típusú gátlás nevezik gátlása visszajelzést vagy visszacsatolásos gátlás. Létét bizonyította minden élő szervezetben. Jelenleg ő tekinthető az egyik vezető típusú szabályozás az enzim aktivitását és a sejtanyagcsere általában.
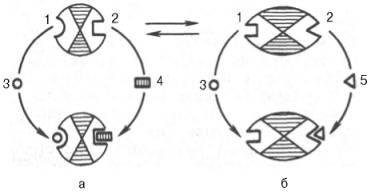
Ábra. 4.25. Allo térbeli kölcsönhatással az enzim egy szubsztrát és effektorok (rendszer).
és - egy aktív készletében; b - inaktív komplexet; 1 - aktív hely; 2 - alloszterikus Center; 3 - egy hordozót; 4 - pozitív effektor; 5 - negatív effektor.
Másrészt, a amfibolicheskih folyamatok végrehajtó egyidejűleg és biodegradativnye bioszintetikus funkciót. létét, szabályozás, mint a visszacsatolásos gátlás típusa és macroergs-cal csatlakozások - mutatók energetikai állapotának a sejt. Mert amfibolicheskih folyamatok egyedi jellegű szabályozás, sajátos, csak őket, ez is egy prekurzor aktiválását. amikor az első metabolitja a többutas aktiválja az enzimet. katalizálja az utolsó lépést. Így, ha bebizonyosodik, aktiváló hatása a glükóz-6-foszfát, prekurzora a glikogén. a glikogén-szintáz enzim.
Hasonló típusú végtermék gátlása és aktiválása az első termék azzal jellemezve alloszterikus (szabályozási) enzimek. Amikor effektor, modulátor, szerkezetileg különböznek a szubsztrátum. kapcsolódó különösen (allosztérikus) központja az enzim-molekula. térben távoli az aktív helytől. Azonban, meg kell jegyezni, hogy allosztérikus modulátorok az enzim lehet, mint aktivátorok. és inhibitorok. Gyakran előfordul, hogy a szubsztrátum maga egy aktiváló hatású. Enzimeket. és amelyek esetében a szubsztrát. és egy modulátort által képviselt azonos szerkezeteket nevezzük gomotropnyh eltérően heterotróf enzimet. amely modulátor kiváló a szubsztrát szerkezetét. Interkonverzióját aktív és inaktív alloszterikus enzim egyszerűsített formában, valamint a konformáció-máció változásokat figyeltünk meg, amikor csatlakozik a hordozó és a effektorok ábrán mutatjuk be. 4.25. Csatlakozási negatív alloszterikus effektor Center okoz jelentős változásokat a konfiguráció az aktív centrum az enzim-molekula. miáltal az enzim elveszti affinitást mutat a saját szubsztrát (a kialakulása egy inaktív komplexet).
Alloszterikus kölcsönhatások nyilvánulnak meg a karakter görbék kezdeti reakciósebesség a szubsztrát koncentráció vagy effektor, különösen a S-görbék a képekkel (eltérés a hiperbolikus görbe Michaelis-Menten). S-alakú függését v [S] jelenlétében a modulátor hatására kooperativitás. Ez azt jelenti, hogy a kötési szubsztrát molekula megkönnyíti a kötődését a második molekula az aktív oldalon. hozzájárulva ezáltal a növekedését reakció sebességét. Továbbá, az alloszterikus szabályozási enzimek a nemlineáris jellemző a függőség a reakciósebesség a szubsztrát koncentráció.
Más típusú szabályozás az enzim aktivitását. Az abszolút enzimmennyiség jelen van a sejtben által szabályozott idején annak szintézisét és a pusztulás. A szabályozási mechanizmusok közé sorolható a verseny az általános enzimszubsztrát. egyszeri aktivitása izoenzimek (több formák enzimek), hatás koncentráció
TIONS cofactors és a jelenség a kompartmentalizációja. Mechanizmus kommunista párt-mentalizációs metabolikus folyamatok nyilvánvalóan fontos biológiai szerepet térben megszakította keresztül biomembránokban enzimekkel azok szubsztrátok (például lizoszomális enzimek proteináz, foszfatáz, RNáz és egyéb hidrolitikus enzimek -... A citoplazmatikus anyagokat, amelyek hatnak) . Ezen túlmenően, hogy elősegítsék a független szabályozás, ez a mechanizmus lehetővé teszi, hogy szét összeegyeztethetetlen az azonos helyen (esetleg egyszerre) anyagcsere-folyamatokat. Egy példa az utóbbi lehet az út szintézisének magasabb zsírsavak. azaz főleg az oldható citoplazmatikus frakciójában. és az útvonal bomlás (oxidáció) a zsírsavak. koncentrálódik a mitokondrium. Meg kell adnia azonban, hogy ha valaki partmentalizatsii probléma a közlekedés metabolitok formájában. és redukáló ekvivalensek keresztül biomembránokban szubcelluláris op-ganell. Ezt a problémát úgy oldjuk meg, egy úgynevezett shuttle mechanizmus, amely lehetővé teszi az átszállítást a metabolitok a formák képesek átjutni a membránon. és biztosítja az intracelluláris homeosztázis (lásd CHAP. 13).
