Meghatározása entrópia növekedés olvadás során kristályos anyag tartalom platform
MEGHATÁROZÁSA entrópia növekedése az olvadó Crystal-kristály ANYAG
A cél a munkát. megérteni a szövege a 2. kezdete termodinamika-O My, hogy a koncepció entrópia és meghatározzák a konkrét entrópia növekszik. Kiegészítők. tégelyt ón, a fűtés (kályha)
hőelem, millivoltméter, gradirovochnaya görbe (meghatározásához hőmérséklet).
Rövid leírása az elmélet és a telepítést. Az első indításakor a termodinamikai-ki mondja, a hőmennyiség átadódik a rendszer megy a növekmény-schenie belső energia, és hogy a munkát a SIS témában.
De az első elv nem határozza meg az irányt a folyamatot. Tehát ne pro-ellentmond a termodinamika első főtétele, spontán újra ütemű belső energiát egy kevésbé fűtött test a fűtés tárgyilagos. A gyakorlatban, egy ilyen átmenet nem figyelhető meg. Meg kell Nai perces vizsgálati orientációs eljárás.
A folyamatot nevezzük visszafordítható, ha a rendszer visszatér az eredeti állapotába, megfordítható folyamat, ha nincs változás a környezetben.
Valódi összefüggő folyamatok visszafordíthatatlan veszteségeket, úgy én hőerőgép, annál jobb, minél közelebb a reverzibilis PROTSES-sous élettartamának. Találunk intézkedés visszafordíthatatlansága iso-ment (rendszer hőszigetelő falak).
Tekintsünk egy ideális gáz bizonyos kókusz-Toyan paramétereket és jellemzi R. V. T. Mivel a molekula mo-gáz ezen a ponton lehet bármely helyét és sebességét, minden makroszkopikus állapotát a rendszer képes lesz a folyamatos változás közel mikroállapot, CO-torye eltérő eloszlása azonos mo-molekulák különböző részein V.
Száma mikroállapot, amely végzett ezt macrostate nevezzük statisztikai súly, vagy termodinamikai valószínűsége Coy e macrostate (W), és jellemzi a véletlenszerűség mértéke a teljes rendszer macrostate.
Minél nagyobb a termodinamikai valószínűsége, annál nagyobb a ste-csonkja rendezetlen a rendszer állapotát.
Boltzmann bevezetett függvényében meghatározó intézkedés bespo-ryadochnosti hőmozgást érték logaritmusával arányos a termodinamikai valószínűsége.
k-, ahol a Boltzmann állandó.
A funkció az úgynevezett entrópia a rendszer. Mivel a termodinamikai valószínűség-kai függvénye állapotjelei, az enter-ropiya is függvénye paramétert.
Amikor olvadó szilárd test van törve mo-rendelési az atomok és molekulák, azonban entrópia a rendszer kell változtatni.
Valószínűségi elmélet ismert, hogy ha a rendszer több önálló részből termodinamikai-tyami valószínűségek W1, W2, ... Wn, termodinamikai valószínűsége, hogy a teljes rendszer:
és entrópia definíció szerint a (2) képietű vegyület.
Ha a mozgás abszolút rendelési rendszer, mint egy állami yanie rendszer az egyetlen módja és termodinamikai valószínűsége W = 1. Ezért, S = 0. Tehát, mint
S. hosszabb van még fokú a molekuláris rendellenesség. Statisztikai és termodinamikai számítások azt mutatták, hogy a növekmény az entrópia-rendszer számszerűen száma egyenlő a hő-ÜZENET schennomu test során egy reverzibilis folyamat, osztva az abszolút-ing test hőmérséklet, amelyen a hő átviteli:
- Ez az úgynevezett csökkentett mennyiségű hőt.
Így, reverzibilis folyamatok azok az eljárások, amelyekben a foka betegség molekuláris mozgásának az egész rendszerben a szervek a folyamatban részt vevő nem növekszik, és az entrópia Pia állandó marad. A visszafordíthatatlan folyamatokat, a véletlenszerűség mértéke molekuláris mozgás növeli és ent-ropiya egész rendszer növekszik.
Ezért az összes folyamat a természetben előforduló,
Ez a matematikai jelölés a termodinamika második törvényének, amely megállapítja, hogy egy spontán hőátadást kevésbé melegítjük több fűtött test nem lehetséges. A fentiekből azt jelenti, hogy a mértéke a visszafordíthatatlanság határozza növekedése entrópia.
A entrópiaváltozás megolvadása után a kristályos test lehet kezelni a képlet (3) differenciális formában;
Használata (4), az első főtétel (1) felírható:
Amikor a hőmérséklet-változás 0 és az egyenlet (5) válik:
ahol - szabad energia, amely egy adott hőmérsékleten lehet használni, hogy a külső munkát, TS - kötött energia az a része, a belső energia, amely egy adott hőmérsékleten nem lehet fordítani a működés.
A (6) ez lehet következtetéseket levonni:
1. A belső energia U a rendszer, az összege a szabad és a kötött energiát.
2. Egy adott T hőmérsékleten külső munkát csak akkor valósítható meg rovására a szabad energia a rendszer.
3. A szabad energia határozza meg a fizikai jelentése az entrópia, annál nagyobb az entrópia, annál kevesebb szabad energia a rendszer, vagyis az entrópia - .. Van olyan intézkedés, az energia egy részét, amelyeket nem lehet használni arra, hogy irányított folyamatokat.
Mi található a képlet az entrópia növekedés olvasztás során a kristályos test. Definíciója szerint az entrópia növekmény
Az indexek 2 és 1 jelzi az elején és végén a test a fűtési folyamat kezdeti hőmérséklet T1, hogy a végén az olvadási folyamatot, amely olyan hőmérsékleten történik, T2:
ahol a C és M a tömeg és hőkapacitása a szilárd anyag egyenlő
ahol A - fajhője olvadó. Behelyettesítve (8) és (9) a (7), kapjuk:
Ebben a dolgozatban meghatározza a növekmény az entrópia, amely független anyag tömegének olvadó.
1. Mérjük meg a levegő hőmérsékletét a laboratóriumban - T /.
2. Kapcsolja be az elektromos lemez, megfigyelni a jelzések mil livoltmetra, és amikor a hőmérséklet 20-30 ° üres világi;
Domer. Vedd millivoltmérövel leolvasott percenként.
3. Kapcsolja ki a cserép után azonnal az olvadt ón.
4. Find az ón hőmérséklet a tégelyben, amelyet a képlet 7 = li ^ ul
ahol // - szobahőmérsékleten Kelvin, 4 / - Show-CIÓ millivoltméter.
Megjegyzés. Scale millivoltmérövel pro végzett Celsius fokban. Mivel hőelem mindig reagál a különbség tempera turnén olvasás millivoltmérövel a különbség a hőmérséklet az ón a tégelyt és a környezetbe.
5. Plot a változás a tégelyben hőmérséklet ón, elhalasztását időt az abszcisszán és az ordináta tengely a hőmérséklet /.
6. Keresse meg a menetrend ón olvadási hőmérséklete 7z •
7. A (II) képletű megtalálni a változás az entrópiában.
1. Hogyan olvassuk az első főtétele?
2. Határozza meg a termodinamika második törvénye.
3. Mi a fizikai jelentését entrópia ^
4. Mit jelent a „energiával kapcsolatos”?
5. Mi a statisztikai igazolása a termodinamika második törvénye?
6. Mi a fajhője olvadó?
7. Mi a szabad energia, és hogyan kapcsolódik az entrópia?
8. Szükséges ebben a tanulmányban, hogy tudja a súlyát ón, és miért?
1. Savelyev Általános fizika. I.-M. T. Science, 1982. p ..
2. Trofimova fiziki. M :. Gimnázium 1985 s.59-92.
MEGHATÁROZÁSA diffúziós együttható és a szabad úthossza a molekulák vízgőz levegőben
Célkitűzés: A tanulmány a jelenség a diffúzió és gyakorlatilag meghatározza
diffúziós együttható. Felszereltség: Légharang otschotny mikroszkóp, hő
• mérő csepegtetős sejt vízzel, küvetta keresztül minden abs-gömbfelület koncentrikus felületi cseppek át kell adnia az azonos mennyiségű anyag szigetek (anyag soha nem fogyasztott, és nem tűnik kívülről).
Egyenletből I, tekintettel arra, hogy L = -5 x g, kapjuk:
Integrálása (2), és feltételezve, hogy az 1 ≤ 1 -i (cseppecske sugár) J ^ a sűrűsége telített vízzel Paratov ezen a hőmérsékleten, fejezzük sűrűsége vízgőz bármely távolságok, eltekintve a csepp Center:
Grafikusan, a függőség a F T ábrán látható. I. A nagysága
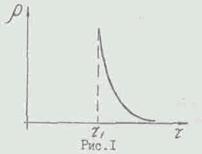
rank p függ az eldobható abszorbens vezetőképes-szárítószer képességét. Ebben a papír, ez gyakorlatilag nulla távolságon néhány nagy, 7 / a, mint egy Execu-szárítóval zuetsya erős szárítószer - szilikagél.
Tekintettel arra, hogy a 7- • ex », p-házban, egyenletből 3 találni képlet
kiszámításakor a diffúziós együttható vízgőz a levegőben:
A tömeges vízgőz keresztül szétterjed lyubuto chesiuta-gömb alakú felület alatt Lt. változásával egyenlő a csepp súlya. akkor időzíteni. Tegyük fel, hogy a T időpontban a sugara cap-Do - 7V és időben 2 „/ -. Z ^ Ezután
Mivel 7 ^ alig különbözik 1 /, majd a következő képlet segítségével számítási hozzávetőleges helyét (7 /
^^) „(5) felírható;
Behelyettesítve (6) (4) találunk
A kinetikus elmélet bizonyítást nyer, hogy
ahol \ L / - közepes szabad úthossza a molekulák;
- számtani közép aránya hőmozgást-zheniya molekulák.
ahol K - az egyetemes gázállandó
/ - abszolút környezeti hőmérséklet, U. - moláris tömege vezető gőz.
Mérése a csepp sugarának a következőképpen: elérni ezt az állapotot a mikroszkóp, amelyekben a szem a skála-LAR mikrométer egybeesik a vízszintes átmérője a csepp és a csepp széle jól látható (3. ábra). Zyate „* eltávolítás állása v megfelel a pozíciókat a jobb és a bal széle a csepp. Radii! cseppek:
Az, hogy a teljesítmény
1. Határozza meg környezeti hőmérsékleten.
2. Egy cseppentőhegy akasztani neboli Shui cseppszámláió.
3. Ellenőrizze a nedvességet.
4. Cover sapka drop és mosogató ..
5. Vigye a mikroszkópot egy csepp.
6. Vegyük az első leolvasó átmérőjű cseppecskék (CLI g), és azonnal hagyja mozogni stopperórát. Az eredményt egy táblázatban a referencia. 10-15 perc múlva, ismét pozícióban dia méteres mikroszkóp tengelyt csepp fókuszálja a képet, ennek eredményeként a cisz-lebegő cseppek átmérője csökken, és annak fókuszáló, eltévedt. Ismét mérjük az átmérője a csepp és állítsa le a stoppert. Továbbra is, hogy távolítsa el a csepp-hsia.
7. Számítsuk ki a diffúziós sebessége a 7 általános képletű, meghatározása a csatolt a munkarend.
Tapasztalat 8. Ismételje 3-szor.
9. A 9 képietű kiszámolása közepes szabad úthossza a Mall-molekulák.
10. Számítsuk ki a mérési hiba.
1. Mi a diffúzió folyamata?
2. mi az. lógó súlya a fényszóró anyag.?
3. Mi határozza meg, hogy a diffúziós együttható és annak fizikai smysl9
4. Milyen hosszú a szabad probega'7
5. Mi a fizikai jelentése az egyetemes gázállandó?
6. Mi a gradiens plotnosti9
7. Derive képletek.
1. Mills fizika. - Moszkva magasabb Iskola 1985 s. 76.
2. Savelyev Általános fizika. T. I. -M. Science, 1982. o.
3. Gorbunova - Workshop a teljes fizike.-M.;
Oktatás, 1978, p. 54-55.
Az, hogy a teljesítmény
1. Határozza meg környezeti hőmérsékleten.
2. Egy cseppentőhegy akasztani neboli Shui cseppszámláió.
3. Ellenőrizze a nedvességet.
4. Cover sapka drop és mosogató ..
5. Vigye a mikroszkópot egy csepp.
6. Vegyük az első leolvasó átmérőjű cseppecskék (CLI g), és azonnal hagyja mozogni stopperórát. Az eredményt egy táblázatban a referencia. 10-15 perc múlva, ismét pozícióban dia méteres mikroszkóp tengelyt csepp fókuszálja a képet, ennek eredményeként a cisz-lebegő cseppek átmérője csökken, és annak fókuszáló, eltévedt. Ismét mérjük az átmérője a csepp és állítsa le a stoppert. Továbbra is, hogy távolítsa el a csepp-hsia.
7. Számítsuk ki a diffúziós sebessége a 7 általános képletű, meghatározása a csatolt a munkarend.
Tapasztalat 8. Ismételje 3-szor.
9. A 9 képietű kiszámolása közepes szabad úthossza a Mall-molekulák.
10. Számítsuk ki a mérési hiba.
1. Mi a diffúzió folyamata?
2. mi az. lógó súlya a fényszóró anyag.?
3. Mi határozza meg, hogy a diffúziós együttható és annak fizikai smysl9
4. Milyen hosszú a szabad probega'7
5. Mi a fizikai jelentése az egyetemes gázállandó?
6. Mi a gradiens plotnosti9
7. Derive képletek.
1. Mills fizika. - Moszkva magasabb Iskola 1985 s. 76.
2. Savelyev Általános fizika. T. I. -M. Science, 1982. o.
3. Gorbunova - Workshop a teljes fizike.-M.;
Oktatás, 1978, p. 54-55.