A termodinamika második törvénye
Ne feledje, a szövege az első főtétele.
Engedélyek, ha az első főtétele, spontán hőátadást kevésbé melegítjük egy fűtött testet?
Hogy vannak-e olyan folyamatok a természetben?
Már jeleztük, hogy az első főtétele - egy speciális esete a törvény az energiamegmaradás.
A törvény az energiamegmaradás azt állítja, hogy az energia mennyisége minden transzformációk változatlan marad. Eközben sok a folyamatok, akkor elfogadható a szempontból a törvény az energiamegmaradás, soha nem fordul elő a valóságban. Például, tekintve az első főtétel az izolált rendszerben lehetséges hőátadást kevésbé melegítjük több fűtött testet, ha a keletkező hőmennyiség forró test, pontosan megegyezik a hőmennyiség adott hideg test. Ugyanakkor, a tapasztalat azt mutatja, hogy ez nem lehetséges.
fontos
A termodinamika első főtétele nem jelzi a folyamatok irányát.
A második törvény termyudinamiki. A termodinamika második törvénye irányát jelzi a lehetséges energetikai transzformáció, azaz a. E. A folyamatok irányát, és így fejezi visszafordíthatatlanságába folyamatok a természetben. Ez a törvény hozta létre közvetlen általánosítása kísérleti tényeket.
Számos készítmények a második törvény, amely annak ellenére, hogy a külső különbségek kifejezve lényegében azonos, és ezért egyenlő.
Német tudós R. Clausius (1822-1888) fogalmazta meg a törvény az alábbiak szerint:
A termodinamika második törvénye
Lehetetlen, hogy a hőt a hideg a forró rendszer hiányában más egyidejű változások mindkét rendszerben, vagy a környező szervek.
Itt azt állítják, a tapasztalt tény egy bizonyos hőátadás iránya: hő önmagában mindig megy a meleg a hideg szervekkel. Azonban a hőátadás végezzük a hideg test hűtőház melegebb, de ez a sebességváltó társul egyéb változások a környező szervek: hűtés valósul meg a teljesítmény rovására.
Annak fontosságát, hogy ez a törvény, hogy a belőle következtetni tudunk a visszafordíthatatlanságáról a folyamat, nem csak a hő, hanem más folyamatokat a természetben.
Hogy érted az „a folyamat irányát?”
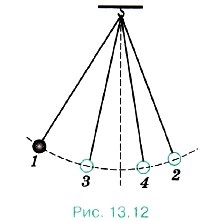
Vegyünk egy példát. Inga oszcilláció outputted az egyensúlyi helyzetből csillapodnak (ábra 13.12.) 1, 2, 3, 4 - az egymást követő pozíciók az inga a maximális eltérések az egyensúlyi helyzet). Mivel a munka a súrlódási erők a mechanikai energia az inga csökken, és a hőmérsékletét az inga és a környezeti levegő (és így a belső energia) enyhén növekedett.
Növelhető ismét swing inga, nyomja a kezét. De ez a növekedés nem fordul elő önmagában, de lehetséges eredményeként egy sokkal összetettebb folyamat, kézmozdulat.
fontos
Mechanikai energia spontán mozog a belső tér, de fordítva nem. Az energia a megrendelt mozgás a test egészének alakul át hőenergiává rendezetlen mozgása alkotó molekulák.
Melyik visszafordíthatatlan folyamatokat lát a mindennapi életben?
Egy másik példa - diffúziós folyamat. Nyitvatartási üvegben parfüm, hamar úgy érzi, a szaga illat. A molekulák az illat miatt a termikus mozgást behatol a tér között, a levegő molekulák. Nehéz elképzelni, hogy mindannyian találkoztak újra a buborék.
A számos ilyen példát növelhető szinte végtelenségig. mind azt mondják, hogy a természetben zajló folyamatok egy bizonyos irányultság, nem tükröződik az első főtétele.
fontos
Minden makroszkopikus folyamatok a természetben zajlik csak egy irányban.
Az ellenkező irányban, nem tudnak spontán fordulhat elő. Minden a természetben zajló folyamatok visszafordíthatatlanok.
Korábban, ha figyelembe vesszük a folyamatok azt feltételezik, hogy visszafordítható.
eszébe jut
Reverzibilis folyamat - ez a folyamat lehet végezni előre és hátra irányban keresztül ugyanazon a köztes állapotok megváltoztatása nélkül a környező szervek.
Reverzibilis folyamat kell eljárni nagyon lassan, úgy, hogy minden köztes állapot volt az egyensúlyt.
eszébe jut
Az egyensúlyi állapotban - olyan állapot, amelyben a hőmérséklet és a nyomás minden pontban a rendszer azonosak.
Következésképpen az a rendszer egy egyensúlyi állapot, ez időt vesz igénybe.
Hogy lehetséges-e, attól függően, hogy a grafikonok ábrázolják macroparameter gáz egyensúlyi állapotok?
Amikor tanulmányozása izoprotsessov azt feltételeztük, hogy az átmenet a kezdeti állapotban a végső áthaladnak az egyensúlyi állapot, és megszámoltuk izoterm, izobár és izochor állapotváltozás reverzibilis.
Ideális reverzibilis folyamatok a természetben nem létezik, de a tényleges folyamat egy bizonyos fokú pontosságot tekinteni reverzibilis, ami nagyon fontos az elmélet.
Statisztikai jellege termodinamika második törvénye. A termodinamika második törvénye határozza meg az irányt a folyamatok egy elszigetelt rendszer, de ez a törvény statisztikai (valószínűségi) karakter.
Bármilyen makroszkopikus rendszer állapotát jellemzi néhány makroparamétert határozza meg mikroállapotok. Például, a gáz nyomás és a hőmérséklet határozza meg a molekulák száma, azok sebessége eloszlása molekulák térfogatának a hajó. Ha a rendszer magára hagyott, és hogy elszigetelt, aztán, mint tudjuk, fokozatosan eléri az egyensúlyi állapot, amelyben a nyomás és a hőmérséklet minden pontján azonos. A folyamat a átmenet a nem egyensúlyi állapotban egyensúlyi - visszafordíthatatlan folyamat.
Az egyensúlyi állapot a kaotikus mozgását molekulák ,. E. A rendszer szempontjából a mikroállamok jön a teljes káosz. Kaotikus mozgások során folyamatos mozgását a gázmolekulák térfogat, árfolyamok. Természetesen, ha képesek vagyunk nyomon követni az egyes molekulák, akkor különböző időpontokban különböző részein jelennek meg a hajó. A molekulák száma a kiválasztott mennyiség, lehetnek különbözőek, és így tovább. D. Ugyanakkor, gáz makró paraméterek nem változtak.
A mozgása molekulák - mechanikai mozgással, amely reverzibilis. Ugyanakkor az összes visszafordíthatatlan folyamatokat, mint például a hőátadás, miatt előforduló mechanikus mozgása atomok és molekulák, mint a molekulák olyan ütközési energia transzfer. Így, visszafordíthatatlan folyamatok következtében reverzibilis mechanikai mozgatás.
Ha csatlakozni a két vitathatatlan tény, Boltzmann fogalmát használta valószínűsége. Így, az állam a gáz, amely a molekulák véletlenszerűen mozog, a legvalószínűbb, a legvalószínűbb, és egy egyenletes eloszlását molekulák edény térfogatánál.
Ugyanakkor lehetőség van arra, hogy mivel a véletlen molekulák mozgásával, akkor találják magukat egy része a hajó, de a valószínűsége egy ilyen állam rendkívül alacsony.
Ennek megfelelően, nem mond ellent a természet törvényeinek, még egy ilyen folyamat, amelyben véletlenszerű mozgás a levegőben molekulák, mindannyian összegyűlnek az egyik fele az osztály, és a diákok a másik fele az osztály megfullad. De reálisan, ez az esemény még soha nem történt a múltban, és fog történni a jövőben. Túl kicsi a valószínűsége egy ilyen esemény, hogy valaha is történt fennállása alatt az univerzum a modern állam - a néhány milliárd év.
Úgy becsülik, hogy ez a valószínűség közel azonos nagyságrendű, mint a valószínűsége, hogy a 20 000 majmok véletlenszerűen üti kulcsok egy írógép, nyomtatott hibák nélkül, „Háború és béke” a LN Tolsztoj. Elvileg ez lehetséges, de ez nem igazán történik.
A határértékek alkalmazhatóságának termodinamika második törvénye. Valószínűsége inverz folyamatát átmenet az egyensúlyi állapotot a makroszkopikus, hogy nem egyensúlyi rendszerek általában nagyon kicsi. Mindazonáltal a kis térfogatú, amely kis molekulák száma, a valószínűsége való eltérés az egyensúlyi észrevehetővé válik.
eszébe jut
Az ilyen random rendszer eltérést egyensúlyi nevezzük ingadozások.
Hogy a gáz sűrűsége ingadozások a területeken a fény hullámhossza sorrendben fényszórás magyarázata a föld és az ég kék színe hangulatot. Nyomásingadozás kis térfogatú magyarázza a Brown-mozgás.
Megfigyelés az ingadozások fontos proof-of-Boltzmann létrehozott statisztikai elmélet visszafordíthatatlanságáról makroszkopikus folyamatokat. A termodinamika második törvénye tart csak olyan rendszerek esetében nagy a részecskék száma. A kis térfogatú vált jelentős eltérés ezt a törvényt.
Kulcsszavak információt keresni a téma ebben a szakaszban.
A termodinamika második törvénye. reverzibilis folyamat
1. Milyen folyamatokat nevezik visszafordíthatatlan? Melyek a legjellemzőbb visszafordíthatatlan folyamatokat.
2. Mint fentebb a termodinamika második törvénye?
3. Mi a helyzet a gáz valószínűleg megfelel az egyensúlyi állapot?