általános kémia
Az elmélet a kémiai szerkezet
Kémiai szerkezete a szekvenciája tartalmaznak a molekulában, a vegyület és ezek relatív helyzetét a térben. Változások Ez a szekvencia képződését eredményezi egy új anyag, amely új tulajdonságokat.
A főbb rendelkezések az elmélet kémiai szerkezete:
1. Az anyagok tulajdonságai határozzák meg a minőségi és mennyiségi összetétele és kémiai szerkezete.
2. soediniyayutsya tartalmaznak a molekulában, összhangban a vegyértékű.
3. Az atomok és csoportok az atomok egy molekulában befolyásolják egymást, ez a hatás gyengül, amennyiben a kölcsönös eltávolítását.
Az elmélet a kémiai szerkezet tervezett AM Butlerov és tanítványai a második felében a XIX.
Kémiai kötés. Főbb jellemzői a kémiai kötés
Tapadás az úgynevezett interakció megtartása atomok molekulák és molekuláris okai a stabilitás bizonyos körülmények között.
Főbb jellemzői a kémiai kötés:
A kötési energia (ERU) - a minimális energia, hogy megtörje a kommunikáció.
Mért elektronvolt (eV) egy csatlakozás vagy kJ / mol egy mol kötések. A kötési energia jellemző kötési szilárdság - minél nagyobb a kötési energia, annál erősebb a kötés.
kötéshossz (LSV) - közötti távolság a magok a összekapcsolódó atomok. Nanométerben van mérve (nm) vagy angströmben (A). Minél rövidebb a kapcsolatot, így általában erősebb.
Telíthetőségével kapcsolat - Ha atom képezi véges számú kötést létesíteni más atomokkai (általában nem több, mint 8) - kötés telítési, ha egy végtelen nagy (nagyobb, mint 1000) - telítetlenséget.
Orientációja kommunikációs -, ha a térben, vannak bizonyos irányban, amely mentén a hatását, a kommunikációs irányul, ha az ilyen irányok nem - nenapravlena.
Energia és kötéshossz jellemző bármilyen kémiai kötés, a telítettség és iránya függ a kommunikáció típusát.
kovalens kötés
Kovalens kötés - atomok közötti kötés belül a teljes elektron párokat.
Amikor két hidrogénatom van két lehetséges esetet:
1. legalább taszító erők az atomok közötti konvergencia-növeli a végtelenségig (1 görbe), az energia a rendszer növekszik, és a rendszer nem tartható fenn.
2. A taszító erő helyébe vonzóerők, hogy elérik a maximális, ha a távolság a magok, egyenlő ro (2-es görbe), a rendszer energiája ebben az állapotban, a minimális és a kevesebb, mint a teljes energia a kezdeti atomok.
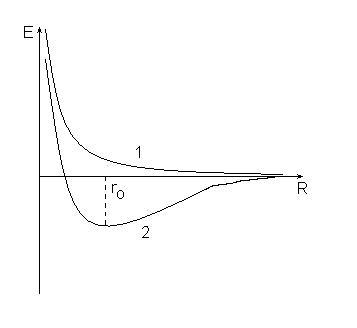
Ez a különbség a viselkedés okozza különböző értékeivel atomi spin-kvantumszám az elektronok a forrás tartalmaz. Ha az elektron spin azonos, akkor ez a görbe 1, ha ettől eltérő - a 2:
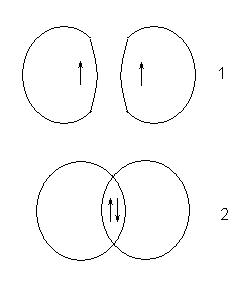
Feltétel, amely ebben az esetben fordul elő, megfelel egy stabil rendszer, amelyben a magok a atomból egy régió fokozott elektronsűrűség. Ez a régió kompenzálja kölcsönös taszítása a magok és a terület az átfedés a pályák hívják vagy közös elektronpár.
Ez képezi egy hidrogén molekulát. Mivel a spin orientációját elektronok hidrogénatom equiprobable (fele a atomok elektron spin +1/2, -1/2 fele), a kialakulását atomi hidrogén molekuláris összes atomok a molekula.
Gyakran ez a folyamat által ábrázolt rendszer volt, amely az elektronok pontot:
és az összes elektron pár - funkció:
A kovalens kötés alakul ki két mechanizmus - csere. amikor az egyes részt vevő kötés kialakulását biztosítja atomok a teljes elektronpár az egyik elektron (A) és a donor-akceptor. ha a donor ad egy elektronpár, míg az akceptor - szabad orbitális (B). Az ábrán a rendszer e mechanizmusok és azok megfelelő valós eljárásban reakció:
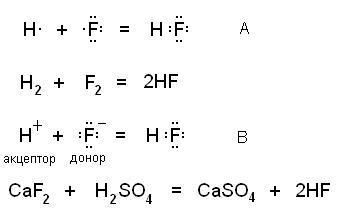
A kapott molekula nem egymástól nem különböznek.
Poláros és apoláros kovalens kötés
Szimmetria szerint az elosztási díj kovalens kötések vannak osztva a poláros és nem poláros.
Ha a teljes elektronpár (a régió átfedési pályák), elhelyezve képest szimmetrikusan kötött magok, az úgynevezett kovalens kötés nem poláros, ha elfogultak egyik magok - poláris kovalens.
Apoláros kovalens kötés keletkezik atomjai közötti ugyanaz az elem, ha ez miatt a szimmetria a töltéseloszlás kapcsolatnak nincs dipólmomentum. Példák a nem-poláros molekulák kovalens kötés: H2. O2. F2, Cl2. N2. AG2.
Ha részt kötjük az atomok különböző elektronegativitása, van egy poláris kovalens kötés. A teljes elektronpár irányába van eltolva az atom nagyobb elektronegativitású, a kapott aszimmetria eloszlása díjak vezet a megjelenése egy dipól kapcsolatot momenta.Chasto offset elektronpárt egy nyilat mutat, például:
Szimbólum azt jelzi, dipólus töltések, ami lehet kevesebb, mint az elektron töltése, de csak együtt léteznek.
Elektronegativitás szénatom függ a hibridizációs a táblázat az összehasonlítás céljából, a relatív elektronegativitási egyes szénatomok és hibrid állapotok:
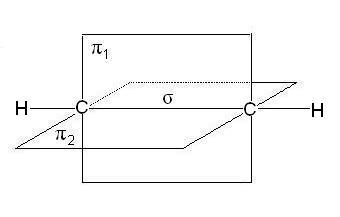
- és -bond
- -bond és megkülönböztetni szimmetria pályák átfedésben.
Ha egy összekötő vonal az összekapcsolódó atomok mag áthalad a az átfedés tartományában a pályák nevezzük a kapcsolat-kötés, ha az átfedő régióban fekszik az oldalán a vonal - -bond.
-kötést az átfedés s-s pályák az atomok (A), p-p pályák (B), S-p pályák (C) és a hibrid pályák:
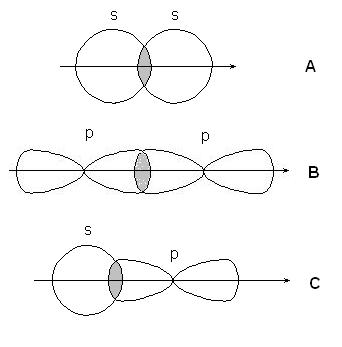
-kommunikáció - átfedő pp pályák:
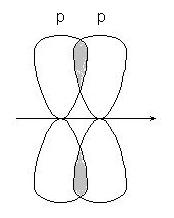
vagy p-d pályák:
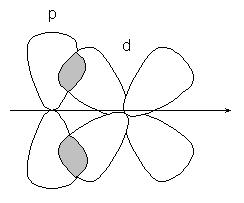
-kapcsolat kevésbé erős, mint kötés, annak az elektronok könnyen előfordulhatott külső befolyást. A vegyületek, amelyek többszörös kötések, csak az egyik linkek -cvyazyu egymást átfedő s, p vagy hibrid pályák, és a többi - -bond egymást átfedő a nem-hibridizált p - pályák az atomok, például kettős kötést hibrid pályák (-bond), és nem részt hibridizációs p pályák (-bond):
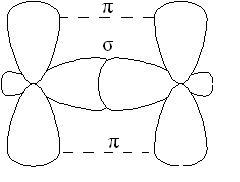
A molekulák alkének, különösen az etilén, a szénatomok dvoynoysvyazi vannak sp2 hibridizációs, minden C-H EC-C -bond egy síkban fekszik, átfedésben nonhybrid p pályákhoz atomok uglerodaproiskhodit síkban merőleges síkban -kötéseken. Néha ez ploskostnazyvayut sík -bond:
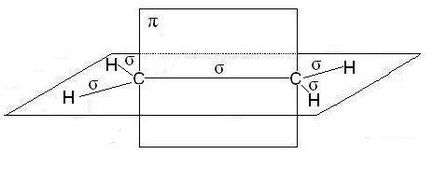
Abban az esetben, a hármas kötés, mint például a molekulák alkinek, mint például acetilén, a szénatom kommunikációs SP-hibridizációs Két -bond kialakítva átfedő nonhybrid p pályákhoz szénatomok (két egyes) fekszenek két egymásra merőleges síkban:
A táblázat felsorolja a főbb jellemzői a kötések között a szénatomok között:
hidrogénkötés
A hidrogén-kötés alakul ki a donor-akceptor mechanizmus közötti hidrogénatom kapcsolódik egy elektronegatív atom és olyan atommal, amelynek egy magányos elektronpár, például:
Hidrogén kötött szénatom képtelen hidrogénkötés.
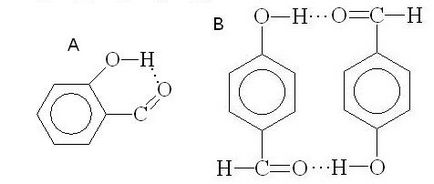
hidrogénkötés energia alacsony (10-40 kJ / mól), mégis nagymértékben befolyásolja a fizikai és kémiai tulajdonságai a vegyületek. Vegyületet intermolekuláris hidrogénkötések sokkal magasabb forráspontú, mint a vegyületek, amelyeknél az azonos molekulatömegű, de nem a kapcsolódó hidrogénkötések. Például, a forrási hőmérsékletet etanol (78,3 ° C) sokkal magasabb, mint a forráspontja dimetil-éter (24 ° C). Ezzel szemben, intramolekuláris hidrogénkötések vezethet alacsonyabb a forráspontja. Például o-szalicilaldehidet (A, intramolekuláris hidrogénkötés) nagyobb illékonyságú képest p - hidroxi-benzaldehid (B intermolekuláris hidrogénkötés):
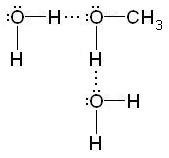
A hidrogén kötések kialakulását magyarázza a oldhatósága számos szerves vegyület poláris oldószerekben. Például, a rövid szénláncú alkoholok hidratálódás bekövetkezésekor vizes oldatban:
Hidrogénkötések fontos szerepet játszanak a kialakulása térbeli struktrury fehérjék, szénhidrátok, nukleinsavak.