Valcncy lítium (Li), és példák a általános képletű
Lítium - az első fém elem. Található, a második időszakban I csoport egy alcsoportja.
Egy egyszerű anyag lítium - lágy ezüstös fehér fém (olvadáspont 180,5 ° C-on, 1336,6 ° C forráspontja közötti hőmérsékleten) (1. ábra). Mivel ez a legkönnyebb fém (sűrűsége 0,539 g / cm 3).

Ábra. 1. Lítium. Megjelenés.
Lítium kémiailag nagyon aktív. Oxigénnel és nitrogénnel reagáltatjuk szokásos körülmények között, azonban azonnal oxidálódik a levegőn, alkotó sötét-szürke por reakciótermékek (Li2 O, LI3 N). Ha a hőmérséklet meghaladja a 200 ° C világítanak. A hangulat a fluor és klór, valamint a bróm és jód begyújtja normál körülmények között.
Vegyértéke lítiumvegyületek
Lítium - harmadik eleme a periódusos táblázat D. Mengyelejev. Nem található a második időszakban a IA-csoport. A 3 mag tartalmaz egy lítium-atom proton és neutron (tömegszáma 7). A lítium-atom, két energiát szint, amely az elektronok 3 (ábra. 2).
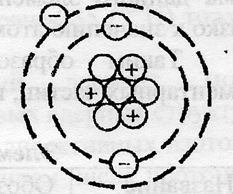
Ábra. 2. Struktúrák lítium atom.
E általános képletű lítium atomok alapállapotú a következő:
És az energia diagramja (épített csak a külső elektron energia szinten, amely különbözőképpen hívják vegyérték):
lítiumatom van egy vegyérték-elektron (párosítatlan), amely azt jelzi, hogy a tipikus lítium vegyértéke azonos I. lítium vegyérték állandó minden vegyületek (Li IH, Li I 2O, Li I OH, Li I NO3. Li I Cl és stb.)
Példák problémák megoldása
Egy tömegű mintát 0,5 g lítium-vízben oldjuk. A töltött neutralizáló kapott oldatot 29,2 g 1,5% -os sósavval. Mi a tömeghányada (%) lítium az eredeti mintában?
Írunk a reakció egyenletet:
LiOH + HCl = LiCl + H2 O (2).
Mi határozza meg a súly és az anyag mennyiségét sósav (móltömeg - 36,5 g / mol):
ω = msolute / msolution × 100%;
msolute = ω / 100% × msolution;
msolute (HCl) = ω (HCI) / 100% × msolution;
msolute (HCl) = 1,5 / 100% × 29,2 = 0438 g;
N (HCl) = m (HCI) / M (HCl);
N (HCl) = 0438 / 36,5 = 0,012 mol.
Határozzuk meg az anyag mennyiségét LiOH, reagáltatunk HCI. Szerint a (2) egyenlet:
n (LiOH): n (HCl) = 1: 1,
jelenti, n (LiOH) = N (HCl) = 0,012 mol.
Meghatározzuk az anyag mennyiségét súly és a tömegaránya lítium a kiindulási mintában (tömeghányad egyenlő 7 g / mol). Szerint (1) egyenlet:
n (Li): n (LiOH) = 1: 1;
n (Li) = N (LiOH) = 0,012 mol.
m (Li) = N (Li) x M (Li);
m (Li) = 0,012 × 7 = 0,084 g;
ω (Li) = msolute (Li) / msolution (új) × 100%;
ω (Li) = 0,084 / 0,5 × 100% = 16,8%.