metastabil fázis
Egy másik fontos példa az eltérés egyensúlyi formáció fázisban átalakítása a metastabil fázisok. Az úgynevezett nem-egyensúlyi fázis, amelyek bizonyos esetekben:
a) Az átmeneti szakaszban a kezdeti és az egyensúlyi fázis,
b) fázis alatt stabilak, bizonyos nyomást arányok, hőmérséklet és koncentráció.
A diagramok a fázisegyensúly ravnovesiymetastabilnye által ábrázolt szaggatott vonalak.
Metastabil fázisok kristályosítása útján képződött elemi anyagok és bináris ötvözetek jelentős túlhűtött olvadékból (oldatok), és a hőmérséklet és koncentráció-tartományban, amelyben ezek a fázisok metastabil, van egy különböző hosszúságú. Izobár izotermikusnak potenciálját a metastabil fázis kisebb, mint az eredeti, de nagyobb, mint az egyensúlyi fázis, így az átalakulás a metastabil fázis egyensúlyi megköveteli bizonyos aktiválási energia hiányában egy metastabil fázis létezhet a végtelenségig.
A formáció metastabil fázis - megszokott jelenség, és széles körben használt és átalakítások a szilárd állapotban. Ez magában foglalja elsősorban a kialakulását túltelített szilárd oldatot, ha azok bomlás végezzük alacsony hőmérsékleten, amikor a diffúzió és kialakulását az egyensúlyi fázisok rendre gátolja.
Minden okunk megvan a feltételezni, hogy a megfigyelt erősen adalékolt félvezetők illeszkedő koncentrációjának elektromosan aktív szennyeződések és általános (kémiai) koncentráció (politrop szennyeződések) van néhány esetben az eredmény a kezdeti szakaszában a bomlás a szilárd oldat, amelyben bevonó folyamat képződő szennyeződések metastabil fázisban.
A leírás, a metastabil fázisdiagramok speciális fázisegyensúly metastabil fázisok - az úgynevezett metastabil diagram. Területek metastabilitás és metastabil kémiai vegyületek az ilyen diagramok azt mutatják, szaggatott vonallal. A kérdés, hogy az alkalmazás a fázis szabálynak a metastabil diagram vitatható. Ábra. 9.3 ábra az egyensúlyi fázisú diagramja rendszerek C és a Co-Ni-C és metastabil ábrák ezeket a rendszereket.
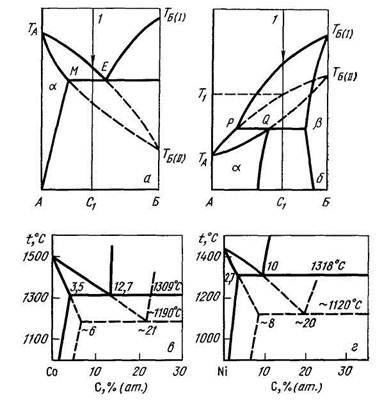
Ábra. 9.3. Metastabil diagram (folyamatos vonal - stabil, alapozott - metastabil egyensúly): és - egy lehetséges metastabil egyensúlyi diagram eutektikus típusú; b - a lehető metastabil egyensúlyi diagramokat peritectic típusú; in - metastabil rendszer diagram Co-C; R - metastabil diagram Ni-C rendszert.
Metastabilitás meghatározott mennyiség közötti különbség az energiákat a metastabil fázis és egy keveréke stabil fázisok. Nagyon nagy hűtési sebesség (10-10 február 10) K / s túlhűtött olvadékok (oldatok) egy bizonyos hőmérséklet alá lehet kapott szilárd metastabil fázis nem csak egy kristályos, de amorf állapotban (amikor egy fázis a rövid távú rendezettséget és nincs hosszú rendezett tartomány a az atomok elrendezése). A ötvözetek az amorf állapotban lehet beszerezni nem csak során a kristályosítás alatt a folyékony fázisban, de közben a lerakódás a gázfázisból. Az amorf állapotban fázisokat kovalens kötés, kevesebb hűtési sebességgel összehasonlítva a fázisokat fémes kapcsolatot.
Ismerve a fázis egyensúlyi diagramot is szükséges, ha kiválasztja kompozíciók a folyékony fázis és a hőmérsékleti körülmények kristályosítás. Ez különösen fontos a készítmény kristályos vegyületek. Tekintsük ezt például termelő egykristály húzva a folyékony fázistól a Czochralski módszerrel.
A kristályosodás következik be-oltókristályként felületével érintkező folyadék olvadék a túlhűtött # 8710; T alatti likvidusz hőmérséklete. Ez hipotermia fenntartása az egész a kristályosodási folyamat. Mivel a kristályosodás új rétegek a szilárd fázis egy oltókristály kihúzták a folyékony fázis. Összetétel kikristályosítjuk a szilárd fázist egyensúly határozza meg fázisdiagram, ha tartani során a rajz folyamat feltételei közel egyensúlyi (kristályosodási sebesség kicsi, széles körben elterjedt diffúziós folyamatok szilárd és folyékony fázis, azaz # 8710; T → 0).
Egybevágóan olvadó vegyületet, például kapu és GA2 TE3 (lásd. Ábra. 8.2 a. L. 8) állíthatók elő a folyékony fázistól ugyanolyan összetételű, mint a vegyület. Ezek úgy állíthatók elő kristályosítással az olvadékból és egy kissé eltérő összetételű: például, a vegyületet kapu - olvadék összetétele X1 kristályosodás hőmérsékleten közötti tartományban 1100 és a 1019 K. Azonban, meg kell jegyezni, hogy ha a vegyület egy bizonyos homogenitást tartományban, majd a a húzott kristály nem lesz sztöchiometrikus összetételű, és lesz egy szilárd oldat határa koncentrációja alapján a vegyület, az egyensúlyi kristályosodási hőmérsékletét.
Inkongruens olvadó vegyületet nem lehet beszerezni a folyékony fázis az ugyanolyan összetételű. Például, ábrán. 8,2 liter. A 8. ábra mutatja, hogy a folyékony fázist, amely a készítmény GaTe3 túlhűtés alatti likvidusz vonal, szilárd fázisú lesz kristályosodni készítmény GA2 TE3. ehelyett GaTe3. Ahhoz, hogy a kristályosodás során a folyékony fázistól felosztott egybevágóan olvadó vegyületet GaTe3. összetétele a folyékony fázis legyen a koncentráció tartományban X2 X3. és kristályosítással kell végezni egy hőmérséklet-tartományban közötti T3 (
760 K), és T4 (709 K). Vizsgálat fenti kristályosítás nem kongruens olvadó vegyületet nevezzük az oldatból kristályosítással.