Gyenge kapcsolat típusok
A több tucat szor gyengébb, mint a kovalens kötés. Ez nem bizonyos típusú kapcsolatok és a nem-specifikus kölcsönhatás, amely akkor fordul elő a különböző kémiai csoportokat, amelyek nagy affinitást mutatnak az egymást (affinitás - ez az átjárhatóság). Például: ellentétes töltésű gyökök.
Így a gyenge kapcsolatot típusok - a fizikai és kémiai kölcsönhatások. Ezért, ezek nagyon érzékeny a környezeti feltételek (hőmérséklet, pH-ja a közeg, az ionerősség az oldat, és így tovább).
Hidrogénkötés - a kapcsolat, amely akkor fordul elő két elektronegatív atom hidrogénkötés miatt, amely kapcsolódik az egyik elektronegatív atomok kovalens (lásd ábra.).
Hidrogén'.ötés körülbelül 10-szer gyengébb, mint a kovalens. Ha hidrogénkötések ismétlődnek, hogy rendelkeznek a polipeptid láncok nagy szilárdságú. A hidrogénkötések nagyon érzékenyek a környezeti feltételek és a bennük levő anyagot jelent, amelyek képesek ilyen csatlakozások (például karbamid).
Ionos kötéssel - között történik a pozitív és negatív töltésű csoportok (további karboxil- és amino-csoportok), amelyek megtalálhatók a gyökök a lizin, arginin, hisztidin, aszparaginsav és a glutaminsav.
Hidrofób interakciós - nem specifikus vonzás között fellépő fehérjemolekula gyökök a hidrofób aminosav - által okozott van der Waals és kiegészített vízzel kilökési erő. A hidrofób kölcsönhatás gyengül vagy törött jelenlétében különböző szerves oldószerek és bizonyos detergensek. Például, bizonyos hatásait etil-alkohol hatása alatt való behatolását a test annak a ténynek köszönhető, hogy a hatása alatt a legyengített hidrofób kölcsönhatás fehérjemolekulák.
A térbeli elrendezése a fehérjemolekula
A szív minden fehérje egy olyan polipeptid lánc. Ez nem csak kiterjesztett térben, és szerveződik háromdimenziós szerkezetét. Ezért van a koncepció a 4 szintű térbeli szerveződésének fehérje - nevezetesen, a primer, szekunder, tercier és kvaterner szerkezete fehérjemolekulák.
Elsődleges szerkezet
Az elsődleges szerkezet a fehérje - aminosav-fragmentumokat szilárdan (és az egész időszakban a lét a fehérje) csatlakozott peptidkötéssel. Van egy felezési fehérjemolekulák - a legtöbb fehérjék körülbelül 2 hét. Ha volt egy szünetet legalább egy peptid-kötés alakul ki egy másik fehérjét.
másodlagos szerkezet
Másodlagos szerkezet - egy térbeli elrendezése a rúd a polipeptid-lánc. Három fő típusa a másodlagos szerkezet:
1) alfa-hélix - vannak bizonyos jellemzői: szélesség, távolság két menet között a spirál. A fehérjék jellemző pravozakruchennaya spirál. Ebben a spirális tekercsek 10 van 36 aminosavat. Az összes peptidet elrendezett spirális, ez a spirál pontosan ugyanaz. Alfa-hélix van rögzítve keresztül hidrogénkötések között az NH-csoport az egyik tekercs turn és a C = O csoportok szomszédos viszont. Ezek a hidrogén kötések párhuzamosan vannak elrendezve, hogy a hélix tengelyével, és megismételjük, így szilárdan tartsa a spirális szerkezet. Sőt, akkor néhány feszült állapotban (például egy nyomórugó).
B
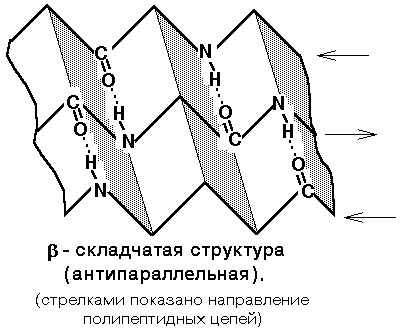
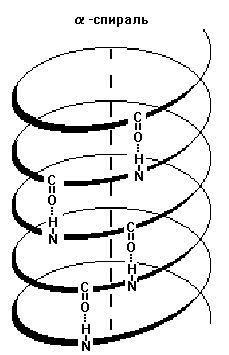
3) szabálytalan szerkezetű - típusú másodlagos szerkezet, ahol az elrendezés a különböző részeit a polipeptid lánc egymáshoz képest nincs állandó (konstans) karakter, azonban szabálytalan szerkezetű lehet különböző konformáció.