Vneshkoly - rövid összefoglalása készítmények egy off in Chemistry №5 szerkezete az atom
Felkészülés UPE. Kémia.
Áttekintés 5. atom szerkezete
Története a felfedezés a szerkezet az atom
Végén XIX - XX század elején fizika bebizonyította, hogy az atom egy összetett részecske, amely egy egyszerű (elemi) részecskéket. Ők találtak:
1. katódsugarak (angol fizikus George. George. Thomson, 1897)
2. A részecskék, amelyek úgynevezett elektronok e - (viselik egyszeres negatív töltéssel);
3. Természetes radioaktivitás elemek (francia tudósok - radiochemists Becquerel és M. Curie Curie fizikus Pierre Curie, 1896) és az, hogy a α-részecskék (hélium atommag);
4. A jelenléte a közepén az atom pozitív töltésű atommag (angol fizikus és radiochemist Rutherford, 1911);
5. Mesterséges átalakítás egyik eleme, hogy egy másik, például nitrogén-, oxigén- (E. Rutherford, 1919 YG). Az egyik eleme az atommag (nitrogén - a kísérletben Rutherford) becsapódáskor a α-részecske-mag képződik egy másik atomot (oxigén) és az új részecske szállító egység pozitív töltés, úgynevezett proton (kernel)
6. A jelenléte elektromosan semleges részecske az atommag - neutronok (brit fizikus J. Chadwick, 1932.).
Ennek eredményeként a vizsgálatok, azt találták, hogy az atom az egyes elemek (kivéve a H) protonok vannak jelen. neutronok és elektronok.
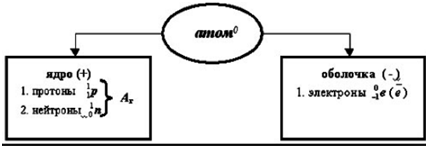
A szerkezet a atom.
Ezen túlmenően, a protonok és neutronok az atommag bepároljuk, és elektronok - a kerületén (a elektron héj).
A protonok száma a sejtmagban száma megegyezik az elektronok a héj az atom, és megfelel a sorszámát ez az elem a periódusos rendszerben.
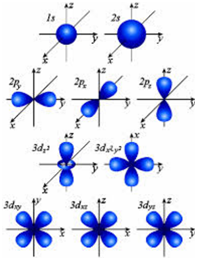
Electron héj Egy atom
Electron héj egy atom egy komplex rendszer. Meg van osztva egy shell egy különböző energia (energia szinten); szintek viszont vannak osztva alréteget, valamint a alrétegek tartalmaznak atomi pályák, hogy változhat az alakja és mérete is (amelyeket a betűk s, p, d, f, stb).
Form S-orbitális - gömb alakú. Forma p-pályák (a számot a p-szintalatti 3) - súlyzó. Form d-pályák (amelyek száma a mindenkori alréteg egyenlő d-5) - bonyolultabb. Még nehezebb, hogy F-pályák, akiknek száma az F-szintalatti 7.
Az alakja atomi pályák.
A maximális az elektronok száma az energia szintje határozza meg a képlet N = 2n². Ahol n számú energiaszintet.
Az eljárás kitöltésére az elektronikus szinten kis időszakok atomok
Ahhoz, hogy az áramkör szerkezet a elektronhéjak atomok kell vezérelnie az alábbi algoritmus:
A. összes számának meghatározására az elektronok a héj által a sorszáma;
B. számának meghatározása energiaszintek időszakra szám;
B. meghatározzuk az elektronok száma az egyes energia szinten (képlet segítségével 2n²)
G. külső elektron héj a fő elemek alcsoportban mennyiségű elektront csoportnak megfelelő számot;
D. a átmeneti csoport elemeinek a külső 2 réteget, az elektron e, van töltve utolsó előtti elektron réteg.
hidrogénatom van egy sorszáma 1 tehát egy elektron. Atom 1 időszakban tehát, az energia szintjét egy atom. Reakcióvázlat elektron-eloszlás a energiaszintek:
)
Írja atommag díjat, aztán konzol szimbolizáló elektronikus szint közelében a jobb alsó konzol levelet az elektronok száma egy adott szinten.
Az elektronok eloszlását az energiaszintet felírható másképp:
Hélium atom sorszáma 2 tehát két elektron. Atom 1 időszakban tehát, az energia szintjét egy atom. Reakcióvázlat elektron-eloszlás a energiaszintek:
He + 2) 2 vagy
lítium-atom sorszáma 3 tehát három elektron. Három az elektron nem fér el az első energiaszint, mert Ez megegyezik a maximális kapacitását 2e (Emlékeztetni képletű 2n²). Következésképpen, az elektron harmadik réteg képez egy második energia. Ez a réteg egy sugara nagyobb, mint az első. Ez tényleg helyzetének felel meg, a lítium, a periódusos kémiai elemek. Atom abban az időszakban 2, tehát két energia egy atom szinten. Reakcióvázlat elektron-eloszlás a energiaszintek:
Li + 3) 2) 1, vagy
Arguing így fontolóra a rendszer a tölteléket a energiaszintjét egyes elemei a kis ideig:
Tulajdonságai elemek periodikusan ismétlődő, mert az atomok az elemek periodikusan ismételjük az elektronok száma a külső elektronikus rétegben.
Az eljárás kitöltésére az elektronikus szintet hosszú időn atomok
A kompozíció a második és a harmadik időszakok közé 8 terméket. A szerkezet a negyedik periódus magában foglalja a 10 elemek nagyobb, azaz a negyedik periódus magában foglalja a 18 elemeket. Hol az elektronok kerülnek a elemet követő kalcium? Emlékezzünk, hogy az elemek B csoport - fémek, amelyeket az jellemez, vegyérték II. Az egyetlen dolog, ami lehet ajánlani - hogy folyamatosan töltsék az utolsó előtti elektron réteg. Tehát, szkandium lehet a következő modell atomi szerkezete:
Sc +21))))
Február 8. február 9.
Tíz „extra” elemei a 4. időszak befejeződött cinkatomot. A külső réteg az elektronikus elem két elektron, és az utolsó előtti - 18.
Zn 30))))
Február 8. február 18
Annak a ténynek köszönhetően, hogy az utolsó előtti réteg elektronikai elemeket a negyedik periódus lehet elhelyezni több elektront 10 a negyedik időtartam 10 kémiai elemek nagyobb, mint a harmadik.
következtetéseket:
1. A rétegek száma az elektronikus atomja száma egyenlő az időszakban, amelyben az aktív elemet.
2. csoportok száma elemeinek a csoportot, amelyhez az elem számával egyenlő a külső elektronok az atom.
3. Időszakos ismételhetőség tulajdonságait kapcsolatos elemeket a tény, hogy az atomok az átmenet az egyik időszakról a új elektronikus kezd megtelni egy réteg, amely periodikusan ismételjük számú külső elektronok egy külső elektronikus réteg.
4. A létezése hosszú időszakok miatt az elektron töltés az utolsó előtti (belső) elektronikus rétegek.
Grafikus program az elektronikus atomok rétegek (katód grafikai képlet)
Ahhoz, hogy leírják a elrendezése elektronok az atomi pályák használt elektronikus konfiguráció.
Mert az ő írása összhangban pályák vannak írva a legenda (s-, p-, d-, f-pályák), és előttük, jelezve a szám az energia szintet. Minél nagyobb a szám, annál nagyobb a elektron a sejtmagban. A felső esetben a kijelölése orbitális írt szám elektronok ezen orbitális.
Elektronikus konfigurációs szkandium atomok.
Az elektronok a külső energia szinten úgynevezett vegyérték.
Arra utal, hogy a d- elemeket.
Grafikusan, eloszlása elektronok atomi pályák is ábrázolhatjuk sejtek alakjában.
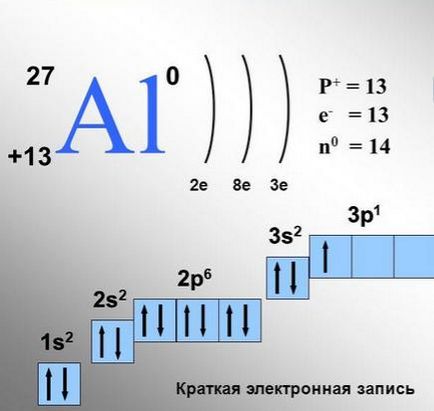
A eloszlása elektronok az atom az alumínium.
Minden cella felel meg egyetlen orbitális. A p-orbitális ilyen sejtek lesz három, a d-pályák - 6:55 F-orbitali-. Az egyik sejt lehet 1 vagy 2 elektront.
Van általában (az úgynevezett szabály Gunda), amelynél elektronok szívesebben rendezni a ugyanaz az energia pályák töltési ezen pályák kezdődik (például, három p-pályák) először egyenként, és csak akkor, ha minden egyes ilyen pályák már az egyik elektron, a második elektronok.
Ha lakott orbitális két elektron, ezek az elektronok úgynevezett páros. Az elektronok lakják, úgy, hogy minden ilyen p-pályák lesz egy elektron. Ezek szerint ez annak köszönhető, hogy az elektronok a szomszédos sejtek kevesebb, taszítják egymást, mint ugyanolyan töltésű részecskék.
Teszt előkészítése Külső vizsgálat:
Online-vizsgálat előkészítése külső vizsgálat kémia №5 „Atomic Structure”