Szabály Duclos-Traube - studopediya
Gibbs egyenlet, amely a jellemző viselkedése során az anyag az adszorpció a mennyisége a származék. azonban értékét koncentrációjával változik a (lásd. ábra. 3.2). Ahhoz, hogy ez a fajta jellemző állandó értéket, figyelembe annak határérték (0). Ez az érték Rebinder P. (1924) nevezett felületi aktivitás g:
Minél több a felületi feszültség csökken növekvő koncentrációban az adszorbeált anyag, annál nagyobb a felületi aktivitása az anyag, és annál nagyobb a Gibbs adszorpciós.
Felületi aktivitás meghatározható grafikusan a negatív meredeksége érintő a görbe = f (c) pontnál az keresztezi az ordináta tengelyen.
Így, egy felületaktív anyag: g> 0; <0, Гi> 0. TID: g <0;> 0, gipsz Gi <0.
Azt találtuk, a következő.
1. Surface Activity (g) csökkenésével növekszik polaritású anyaggal. Ezért a felületi aktivitás szerves savak nagyobb, mint az érték g sói, például:
Ez azt is megmagyarázza az inaktivitási szacharóz, olyan molekula, amely mellett a nem-poláros szénhidrogén váz egy csomó poláros csoportokat a molekulában, így van egy egyensúly a poláros és nem poláros részeket.
2. A homológ sorozat vezethető egyértelmű minták a változások a felületi aktivitás (g): növelésével növekszik hossza a szénhidrogéncsoport.
Ennek alapján a nagy terjedelmű kísérleti anyag a végén XIX. Duclos és Traube megfogalmazott szabály:
Felületaktív-ségét korlátozza zsírsavak vizes oldatok növekszik 3,5-szerese a 3- szénhidrogén lánc nyúlása az egyik linkre (-CH2-csoport).
Ábra. 3.4 ábra a izotermák a felületi feszültség számos savak.
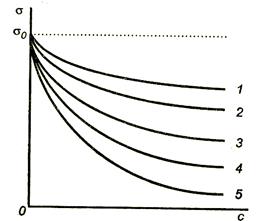
Ábra 3.4. Isotherm felületi feszültség az egyes savak
Így, g1 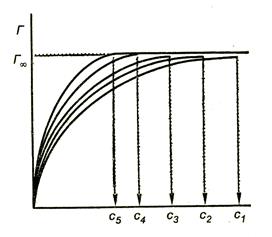
Ábra 3.4. Az adszorpciós izoterma savak
Elemzés feltárja izotermák alábbi minták:
Az a tény, hogy a vakolat Gi (minden esetben hajlamos. Magyarázhatók adszorpciós monomolekulás. De hogyan tudjuk megmagyarázni, hogy a maximális adszor homológ sor nem függ a hossza a szénhidrogén-csoport? Talán csak egy szigorúan meghatározott elrendezése molekulák felületi réteg.