Formula propionsav kémia
A definíció és képlet propionsav
Propionsav (-propánsav) sav - egy komplex szerves vegyület osztályába tartozó határértéket monokarbonsavak.
Normális körülmények között, ez egy színtelen folyadék, fanyar szúrós szagú. Autoignites hőmérsékleten 440 o C elegyedik a víz és szerves oldószerek.
Kémiai képlet propionsav
Kémiai képlet propionsav lehet rögzíteni két módon: C2 H5 COOH vagy C3 H6 O2. Ez azt mutatja, hogy a szerkezet ezen molekula három szénatomot tartalmaz (Ar = 12 amu), hat hidrogénatomok (Ar = 1 amu) és a két oxigénatom (Ar = 16 AU m.). Szerint a kémiai képlet számított molekulatömege propionsav:
Úr (C3 H6 O2) = 3 × 12 + 6 × 1 + 2 × 16 = 36 + 6 + 32 = 74.
Structure (grafikus) -propionsav képletű
Structure (grafikus) -propionsav képletű sokkal jobban használható. Ez azt mutatja, hogy az atomok vannak csatlakoztatva egymáshoz a molekulán belül (ábra. 1).
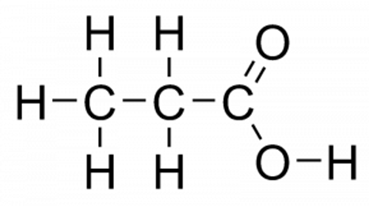
Ábra. 1. propionsav. Grafikus formula.
Példák problémák megoldása
Monokarbonsavat tartalmaz 26,1% szenet és 4,3% hidrogénatom. Mindezek alapján a referencia feltételek teszik szükséges számításokat és állítsa molekuláris képlete a szerves anyag.
Írunk molekuláris képlete egybázisú karbonsavak általános formában Cx Hy Ow.
ω (C) - ω (H) - ω (O) = 100%.
Ezután a tömeghányada az oxigén a összetétele a marginális egybázisú karbonsav kell kiszámítani, mint:
ω (O) = 100% - ω (C) - ω (H);
ω (O) = 100% - 26,1-4,3 = 69,6%.
x: y: w = ω (C) / Ar (C). ω (H) / Ar (H). ω (O) / Ar (O);
x: y: W = 26,1 / 12. 4.3 / 1. 69,6 / 16;
x: y: w: = 2,18. 4.3. 4,35 = 1: 2. 2.
Ezért legegyszerűbb képlet egybázisú karbonsav lesz formájában CH2 O2 vagy HCOOH. Ez hangyasavat.
Amikor a teljes elégetése szénhidrogén képződött mennyisége 14,08 g szén-oxid (IV) és 3,6 g víz. Find molekuláris képlete az anyag, ha a relatív sűrűsége gőzének hidrogén 39.
Aminosavak alkotják az égési reakcióvázlatban jelző szénatomok száma, hidrogén, oxigén és nitrogén a «x», «y», «z» és a «K» rendre:
Tömegének meghatározásához az elemek alkotják az anyag. Az értékek a relatív atomi tömegeket venni a periódusos D. Mengyelejev, egész számra kerekítve: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Kiszámítjuk a moláris tömege a szén-dioxid és víz. Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = [14,8 / 44] × 12 = 4,04 g;
m (H) = 2 × 3,6 / 18 × 1 = 0,4 g
Határozza meg a kémiai képlete szénhidrogén:
x: y = m (C) / Ar (C). m (H) / Ar (H);
Ezért a legegyszerűbb képlet CH, móltömege 13 g / mol [M (CH) = Ar (C) + Ar (H) = 12 + 1 = 13 / mol].
Moláris tömeg szerves anyag lehet meghatározni a sűrűsége a hidrogén:
Msubstance = 2 × 39 = 78 g / mol.
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyület kapott móltömeg:
Msubstance / M (CH) = 78/13 = 6.
Ezért az indexek a szén- és hidrogénatomok kell lennie 6-szor nagyobb, azaz a szer általános képlete a C6 H6 nézet .Ez a benzol.