A vegyértéke kobalt (Co), és példák a általános képletű
Általános információk az oxidációs állapotú kobalt
Kobalt - eleme a VIII csoportba a negyedik periódus járulékos (B) a periódusos rendszer az alcsoport. Metal. Rendeltetése - Co. Sorszám - 27.
Egy egyszerű anyag kobalt - fényes fehér fém sárgás árnyalatú. Ehhez képest a kobalt a vas keményebb és törékeny. A sűrűsége 8,90g / cm3 Olvadáspont 1492 ° C Forráspont 2960 ° C-on
Cobalt két módosításokat. Ahhoz, hogy 430 o C α-kobalt stabil hexagonális, szoros csomagolt rács, a fenti 430 C o - β-kobalt egy lapcentrált köbös rács.
A vegyérték-kobalt vegyületek
Kobalt - huszonhetedik eleme a periódusos DI Mengyelejev. Ez a negyedik időszak VIIIV csoportban. A mag a kobalt atom tartalmazza 27 protont és 32 neutront F (tömeg szám 59). A kobalt atom négy energia szint, amely az elektronok 27 (ábra. 1).
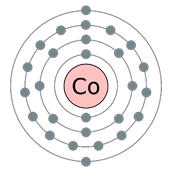
Ábra. 1. A szerkezet a kobalt atom.
E általános képletű kobalt atomok alapállapotú a következő:
És az energia diagramja (épített csak a külső elektron energia szinten, amely különbözőképpen hívják vegyérték):
Miután három párosítatlan elektront azt jelzi, hogy a kobalt vegyületek mutatnak a saját vegyérték III (CO2 O3. Co (OH) 3. CDCL3. Co2 S3). Ismeretes, hogy a kobalt is jellemzi vegyérték II (CoO, Co (OH) 2. CoCl2. CoBr2).
Példák problémák megoldása
Kobalt tömegű 2,95 g-ot feloldunk sósavval, a keletkezett sót kobalt (II), a kapott oldatot átbocsátjuk egy hidrogén-szulfid. Tömegének meghatározásához a csapadék képződik.
Írunk az egyenleteket reakciók említett probléma:
Azt találjuk, a mennyiségű kobalt anyagot reagáltatunk (moláris tömeg - 59 g / mol):
n (Co) = M (Co) / M (Co);
n (Co) = 2,95 / 59 = 0,044 mól.
Szerint (1) egyenlet n (Co). n (CoCl2) = 1: 1, ezért, N (Co) = N (CoCl2) = 0,044 mol. Ezután a mólszáma kobalt-szulfid (II) (pellet) is egyenlő 0,044 mol, mivel n (CoCl2). n (COS) = 1: 1. Mass kobalt-szulfid (II) (moláris tömeg - 91 g / mol):
m (COS) = N (COS) × M (COS);
m (COS) = 0,044 × 91 = 4004 g
Mass kobalt-szulfid (II) egyenlő 4004 g
A standardpotenciál nikkel több mint kobalt (E o Co 2+ / Co o = -0,27 B, E o Ni 2+ / Ni 0 = -0.25 V). meghatározza, hogy az arány változhat, ha a mért potenciál nikkel az oldatban való ion koncentrációjú 0,001 mol / dm 3, és a potenciális kobalt - egy koncentrációjú oldatot 0,1 mol / dm 3.
Definiáljuk az elektród potenciálja kobalt és nikkel a meghatározott körülmények között a Nernst-egyenlet:
E „Ni 2+ / Ni 0 = -0.25 + (0,059 / 2) × LG10 -3;
E „Co 2+ / Co o = -0,27 + (0.059 / 2) × LG10 -1;