szerves kémia
Szerves kémia. A molekuláris szerkezete kémiai kötések Carbon AG
A kémiai természete, a szén-, közbenső között fémek és nem fémek jellemző lehetővé teszi, hogy kovalens kötések kialakítása számos eleme, gyakran hidrogén, oxigén, nitrogén, halogén, kén és a foszfor. Carbon képez kapcsolatot a magas fokú ionos jellegű, több elektropozi fémek, de az ilyen anyagok, nagyon reaktív és intermedierként kerülnek felhasználásra a szintézisben. Szén-szén kötés kovalens természetűek, és egyszerűen (egyszeres), két-, három-és aromás
(Lásd. A molekuláris szerkezete).
Aromás rendszerek. Benzol - őse osztályát aromás vegyületek - egyedülálló stabilitás és belép kémiai reakciók más, mint a reakció a nem aromás rendszerek. Vannak még más aromás rendszerekkei, a leggyakoribb, amely rendelkezik p-pályák hozzáférhető alkotnak p-kötés, minden atom a gyűrű. Öttagú gyűrűs rendszerek két konjugált (azaz váltakozva egyszerű) kettős kötést és ötödik csoportot hordozó egy osztatlan elektronpárt is azok aromás tulajdonságú. Az alábbiakban néhány ilyen rendszerek:
A koncepció aromatikusságának összeállított egy német vegyész E. Hückel. Szerint a Hückel-szabály, lapos gyűrűs konjugált rendszer száma p-elektronok 4n + 2, aromásság és stabil, és ugyanaz a rendszer száma p-elektronok 4n - antiaromaticity és instabil.
Stabilitása gyűrűs rendszerek. Bond szög (szög közötti kötéseket) a feszültségmentes fragmens C-C 109b °, és a gyűrű, amely tárolja az értéket, hogy sokkal stabilabbak, mint azok, ahol a szögek erősen eltérnek a ezt az értéket. A feszültség előállított gyűrűs rendszerek eredményeként torzulásának kötésszöget, az úgynevezett Bayer - miután a német vegyész A. Bayer, javasolta először ez a magyarázat fenntarthatóságát telített gyűrűket. Így a három-tagú gyűrűk, ahol a vegyérték szöge csak 60V °, nagymértékben feszülő gyűrűt, és könnyen szakadt; azok egyes reakciók hasonlítanak a reakció a kettős kötés a C = C Négy-tagú gyűrűk is feszített (vegyérték szög 90B °), de nem annyira. Öt-tagú gyűrűk majdnem lapos és szögek egyenlő 108B °; így nenapryazhen és stabil. A hat-tagú gyűrűt, például a ciklohexán, szénatomok nem fekszenek ugyanabban a síkban; az ilyen hurkok vannak hajlítva, ezáltal csökkentve a feszültség gyűrű. Öt- és hattagú gyűrűk a leggyakoribb. Nagy gyűrűk szintén képesek csökkenteni a feszültséget a szögletes ráncosodás, de néhány közülük (a hét- tizenkét-tagú) hidrogénatom ellentétes oldalán a gyűrű közelebb össze úgy, hogy a taszítás teszi őket kevésbé stabil vegyületet (prelogovskoe feszültség vegyész által a nevét a svájci V.Preloga aki felfedezte ezt a hatást).
Tautomerizmust. Ha egy molekula vagy ion leírható több szerkezete különbözik egymástól csak elektron eloszlás, ezek a struktúrák úgynevezett rezonancia, és a rezonancia formák nincsenek egyensúlyban egymással egyszerűen a tényleges elektronikus a molekula szerkezete van valami két véglet között. Vannak azonban olyan helyzetek, amelyekben az atomok mozognak a molekulában normál körülmények között gyorsan közötti különböző molekuláris formájával spontán egyensúlyi állapot jön létre. Ezt a jelenséget nevezzük tautomerizmust. Egy példa az egyensúlyi közötti keton és enol (keto-enol tautoméria):
Itt, a két vegyület csak abban különböznek, elrendezése a hidrogén-kation és az elektron párokat (p-kapcsolatban). Egyensúlyi állapot jön létre gyorsan, de határozottan előnyben részesíti a keto formában. Következésképpen, alkoholokkal a szerkezet -C = C-OH jellemzően instabil, és gyorsan átalakul A keto forma, ha nem bizonyos szerkezeti jellemzői, amelyek stabilizálják az enol-formában, például fenolok, amelyek a átmenet a keto forma elveszítené aromás jellege:
Tautoméria szokásos molekulák, amelynek a szerkezete -CH = X vagy -C = XH, ahol X - jelentése S, O vagy N. Tehát, a molekula H2C = C (NH 2) -CH 3 gyorsan rendeződik át H3C-C (= NH) - CH3, és imidek RC (OH) = NH amidokat átrendezett RC (= O) NH2. Tautoméria gyakori az ilyen biológiailag fontos heterociklusos rendszerek, mint például barbitursav és rokon vegyületek:
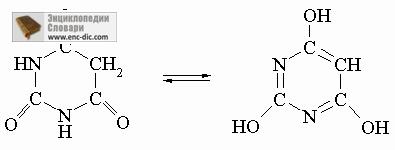
További gyors egyensúlyt. Vannak más gyors egyensúlyi molekulák közötti hasonló szerkezetek. Ha egy és ugyanazon a szénatomon bármely két csoport OH, SH vagy NH2 csoport, a vegyületet szokásosan instabil képest dvoesvyaznoy formában:
Vannak olyan esetek, amikor ez az egyensúly felé tolódik a dihidroxi-vegyület. Gáznemű formaldehid CH2 = O szerkezetű, de vizes oldatban ez magában foglal egy vízmolekula, megtalálása HO-CH 2-OH, mint az uralkodó forma. Klorál-hidrát Cl3CCH (OH) 2 viszont eléggé stabil dihidroxivégződésű formában elektron-impakt három klóratom.
B. izoméria
Izoméria szénlánc. A molekulák, amelyek egymástól csak a elágazása a szénlánc, úgynevezett láncú izomerjei. Egy példa már adott - ez egy izomer pár n-bután és izobután.
Izoméria funkciós csoportok. Molekulákat ugyanazzal az empirikus képletű, de a különböző funkciós csoportok funkcionális izomerek, mint például etil-alkohol C2H5OH és dimetil-éter CH3-O-CH 3.
Helyzeti izomer. Helyzeti izomer Az azonos molekuláris képietű, és a funkcionális csoportokat, de a helyzet a funkciós csoportok a saját molekulák különböző. Így, CH3CH2CH2Cl 1-klór-propán és 2-klór-propán CH3CHClCH3 helyzeti izomer.
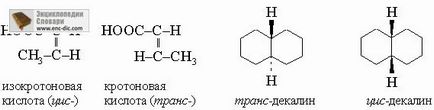
Geometriai izomerek. Geometriai izomerek állnak azonos atomokból ugyanazt a szekvenciát, de különböznek a térbeli elrendezése az atomok képest a kettős kötések vagy gyűrű. Cisz-transz izomerek az olefinek és a szin-anti-oxim-izomerek az ilyen típusú.
Segítség keresők