Langmuir adszorpciós
Itt vannak a főbb rendelkezéseit, ezt az elméletet.
1. Az adszorpciós monomolekulás.
2. Az adszorpciós egy dinamikus egyensúly, amely lehet tekinteni, mint quasichemical. A körülmények egyensúlyi adszorpciós és deszorpciós reakciósebességet egyenlő.
Adszorpciós egyensúlyi állandó
ahol kads- adszorpciós állandó sebességgel; kdes- állandó sebességgel deszorpció.
Egyenlet alapján származik az elmélet, amit közölt nélkül levezetés:
ahol - a maximális adszorpciós a felületaktív anyagot; D - koncentrációban adszorpció; K - állandó adszorpciós egyensúlyi helyzet.
A függőség adszorpciós koncentráció ábrán látható 3.7.
Három jól látható része a görbe:
I rész - egyenes áradó eredetű. Valóban, a Langmuir egyenletet (3,15) alacsony koncentrációban Kc <<1,1 + Кс 1 и .
III szakasz - felel meg, egy vonal párhuzamos az x-tengely, ami azt jelenti, hogy az adszorpciós elérte a korlátait. Ebben az esetben a Kc >> 1 és 1 + Kc Ks. ezért
II hely - megfelel a hajlított rész a grafikonon, és leírt teljesen eravneniem Langmuir (3,15).
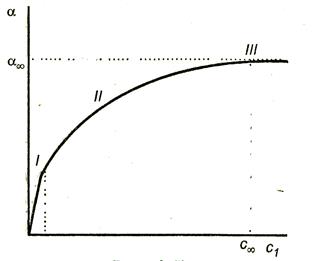
Ábra 3.7. A függését adszorpciós felületaktív anyag koncentrációt.
Ahhoz, hogy megtalálja a konstansokat a Langmuir egyenletet, akkor azt kell eredményeznie, lineáris formában. Ehhez szükségünk van a „flip” a jobb és a bal oldalon az egyenlet:
Szorozzuk egyenlet mindkét oldalát (3.16): E
Ábra. 3.8. grafikonját mutatja.
A lejtőn a vonal az abszcissza
Intercept egy egyenes vonal az y-tengelyen,
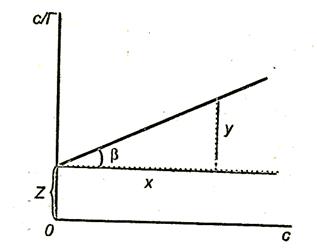
Ábra 3.8. A függőség C / R a felületaktív anyag koncentrációja.
Bebizonyosodott, hogy a K az egyenletben Shishkovsky (fajlagos kapilláris állandó) és a K-egyenlet Langmuir (adszorpciós egyensúlyi állandó) - ez egy és ugyanaz a mennyiség.
Függvényében ábrázoljuk. Itt található a határ adszorpciós és állandó adszorpciós egyensúlyi K.
Mivel adszorpciós tekintik psevdohimicheskaya reakciót alapuló kémiai termodinamika felírható
Shishkovsky empirikusan találtuk, hogy a K konstans növeljük 3,5-szer 3- nyúlási lánc egy linket -CH2.
Írunk a kifejezés a különbség a munka adszorpciós két szomszédos tagja a homológ sor.
= 8,31 * 298 * A 3,5 3,2 kJ / mol,
ahol n - a szénatomok száma a szénhidrogéncsoport.
Ez azt jelenti, hogy minden egyes átviteli - CH2- csoport a felületi réteg egy ömlesztett fázist kell fordított 3.2 kJ / mól energia. Ez a munka razdvizheniya vizet dipólusok a térfogat - CH2- csoport, - értékét az adalékanyag és az ugyanezt a különböző sorozat limit alifás vegyületek. Állandó különbség adszorpciós munkák két szomszédos tag alakítjuk állandó arányban (3- 3,5), megjelenő a szabály Dyuklo- Traube. Ennek lényege, alapvetően tehát abban rejlik, hogy a munka adszorpciója egyes - CH2- csoport az állandó közel 3,5 kJ / mol.
Összefoglalva, a mellett Gibbs egyenlet Shishkovsky és Langmuir egyenlet Frumkina létezik, amely lehetővé teszi, hogy kiszámítja a változás felületi feszültség következtében adszorpciós